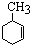11.下列说法不正确的是( )
| A. | 生物质能来源于植物及其加工产品所贮存的能量,绿色植物通过光合作用将化学能转化为生物质能 | |
| B. | 用氨水法处理燃煤烟气中的二氧化硫,即可消除其污染,又可得到副产品硫酸铵 | |
| C. | 某小组研究人员成功制备出了四氧化铱正离子(IrO4+),其球棍模型为 ,由此可判断其中铱元素显+9价 ,由此可判断其中铱元素显+9价 | |
| D. | 门捷列夫根据元素性质随元素的相对原子质量递增而显现元素周期性变化的规律排出了第一张元素周期表 |
9.下列递变情况中,正确的是( )
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
8.下列说法正确的是( )
| A. | NA代表阿伏加德罗常数,1molC4H10中含共价键数目为14NA | |
| B. | 某反应的△H=-88kJ•mol-1,则正反应活化能一定小于88kJ•mol-1 | |
| C. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
7.元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是( )
| A. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| B. | 某微粒的结构示意简图为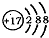 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | Be(OH)2的碱性比Mg(OH)2的碱性强 | |
| D. | 原子半径:Na>Si>O |
3.下列有关阳离子的说法中错误的是 ( )
①非金属原子不能形成阳离子;
②阳离子都是由一个金属原子失去电子而形成的;
③阳离子的价态不会大于其原子的最外层电子数;
④阳离子都是稳定结构,不会再失去电子;
⑤阳离子的电子排布一定与稀有气体元素原子相同.
0 167067 167075 167081 167085 167091 167093 167097 167103 167105 167111 167117 167121 167123 167127 167133 167135 167141 167145 167147 167151 167153 167157 167159 167161 167162 167163 167165 167166 167167 167169 167171 167175 167177 167181 167183 167187 167193 167195 167201 167205 167207 167211 167217 167223 167225 167231 167235 167237 167243 167247 167253 167261 203614
①非金属原子不能形成阳离子;
②阳离子都是由一个金属原子失去电子而形成的;
③阳离子的价态不会大于其原子的最外层电子数;
④阳离子都是稳定结构,不会再失去电子;
⑤阳离子的电子排布一定与稀有气体元素原子相同.
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |

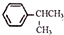 可写成
可写成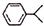
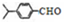 ,上述合成路线中①属于加成反应;
,上述合成路线中①属于加成反应;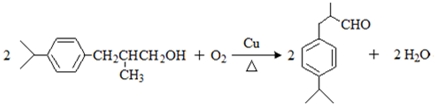 .
.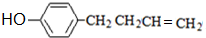 .
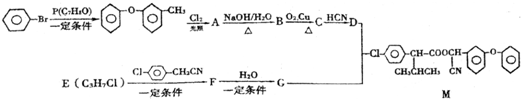
.
 .
.
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
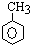 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$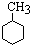
 _
_