题目内容
7.元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是( )| A. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| B. | 某微粒的结构示意简图为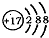 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | Be(OH)2的碱性比Mg(OH)2的碱性强 | |
| D. | 原子半径:Na>Si>O |
分析 A、还原性的强弱跟失电子的难易程度有关;
B、结构示意简图为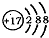 ,是氯离子,氯元素在周期表中位于第三周期、VⅡA族;
,是氯离子,氯元素在周期表中位于第三周期、VⅡA族;
C、元素金属性越强,最高价氧化物对应水化物的碱性越强;
D、电子层数越多半径越大,电子层数相同核电荷数越多半径越小.
解答 解:A、还原性的强弱与失电子的多少无关,而跟失电子的难易程度有关,故A错误;
B、结构示意简图为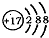 ,是氯离子,氯元素在周期表中位于第三周期、VⅡA族,故B错误;
,是氯离子,氯元素在周期表中位于第三周期、VⅡA族,故B错误;
C、元素金属性越强,最高价氧化物对应水化物的碱性越强,因为金属性Mg>Be,所以Be(OH)2的碱性比Mg(OH)2的碱性弱,故C错误;
D、Na和Si三个电子层,电子层数相同核电荷数越多半径越小,即Na>Si,半径而O是两个电子层,半径最小,所以半径:Na>Si>O,故D正确;
故选D.
点评 本题考查元素周期律的相关知识,学生要清楚元素金属性的强弱与失电子的多少无关,而跟失电子的难易程度有关,比较容易.

练习册系列答案
相关题目
15.已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| B. | 向2.0×10-4 mol/L的K2CrO4溶液中加入等体积的2.0×10-4mol/AgNO3溶液后,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中的Cl的物质的量浓度最大 | |
| D. | 将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L的K2CrO4的混合溶液中,则先产生AgCl沉淀. |
12.下列有关实验操作或原理正确的是( )
| A. | 取少量硫酸亚铁铵品体溶于水,先加入氯水,再滴入几滴硫氰化钾溶液,溶液变血红色,则可证明品体的成分中含有Fe2+ | |
| B. | 用到金属钠时,要用镊子取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| C. | 用pH计分别测定0.1mol•L-1的FeCl3和0.01mol•L-1FeCl3的pH,可以比较浓度对盐类水解程度的影响 | |
| D. | 通过测定等物质的量浓度的NaCl、Na2S溶液的pH,比较硫、氯两种元素的非金属性强弱 |
16. 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
 利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )
利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图:a、b为惰性电极.利用该装置将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的.下列说法不正确的是( )| A. | a为负极,电极反应式为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| B. | 反应过程中产生的质子透过阳离子交换膜扩散到好氧区 | |
| C. | 装置中的离子交换膜是阳离子交换膜 | |
| D. | 该装置把电能转化为生物质能 |
17.下列溶液中粒子的物质的量浓度关系一定正确的是( )
| A. | 常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(H2A) | |
| B. | Na2CO3溶液:c(H+)-c(OH-)=c(HCO3-)+2c(CO32-)-c(Na+) | |
| C. | 向NaOH溶液中滴入CH3COOH溶液后溶液显碱性:c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1mol•L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2mol•L-1 |
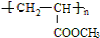
 ,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
,已知B、C、D、E、F五种烃有如下转化关系,B为苯的同系物,最多只有13个原子处于同一平面上,D中所有的原子一定在同一平面上.
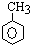 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$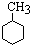
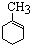 _
_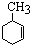
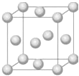 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.