14.相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)?2SO3(g)+197kJ 实验测得有关数据如下:下列判断中正确的是( )
| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
| A. | 两容器中反应的平衡常数不相等 | |
| B. | 达到平衡时SO2的体积分数:甲<乙 | |
| C. | 197>Q1>Q2 | |
| D. | 生成1molSO3(l)时放出的热量等于98.5kJ |
12.最近科学家制造出原子序数为112号的新元素,其相对原子质量为277,下列有关112号元素的说法正确的是( )
| A. | 该元素原子的中子数为112 | B. | 该元素原子的质子数为165 | ||
| C. | 该元素原子的核外电子数为112 | D. | 该元素原子的核电荷数为277 |
11.已知工业上真空炼铷的原理如下:2RbCl+Mg?MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是( )
| A. | 铷的金属活动性不如镁强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性不如Rb强 | |
| D. | 铷的单质状态较化合态更稳定 |
10.一定温度下,某密闭容器中的反应为:aX(g)+bY(g))?cZ(g)+dW(g),经5min达到平衡,X减少n mol/L,Y减少n/3mol/L,Z增加2n/3mol/L.若将体系压强增大,W的百分含量不发生变化,则a:b:c:d为( )
| A. | 3:1:2:1 | B. | 1:3:2:2 | C. | 1:3:1:2 | D. | 3:1:2:2 |
9.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为 ( )
0 167002 167010 167016 167020 167026 167028 167032 167038 167040 167046 167052 167056 167058 167062 167068 167070 167076 167080 167082 167086 167088 167092 167094 167096 167097 167098 167100 167101 167102 167104 167106 167110 167112 167116 167118 167122 167128 167130 167136 167140 167142 167146 167152 167158 167160 167166 167170 167172 167178 167182 167188 167196 203614
| A. | 872kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
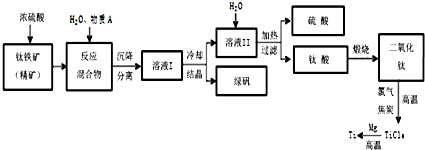
 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O