题目内容
9.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为 ( )| A. | 872kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
分析 化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,依此结合反应方程式进行计算.
解答 解:氢气完全燃烧生成水蒸气是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为Q,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,则:4×121kJ=4×463kJ-(2Q+496kJ),解得Q=436KJ,
故选C.
点评 本题考查反应热的相关计算,难度不大.要注意平时基础知识的积累.

练习册系列答案
相关题目
19.用加热的方法可分离的物质组是( )
| A. | 碘和NH4Cl固体 | B. | NH4Cl和食盐固体混合物 | ||
| C. | 碳酸氢铵和过氧化钠 | D. | NH4Cl和消石灰固体混合物 |
20.在实验室中,除去Cl2中混有的水蒸汽和HCl气体,选用药品及顺序正确的是( )
| A. | 水、碱石灰(CaO+NaOH) | B. | 饱和食盐水、浓H2SO4 | ||
| C. | 无水CaCl2、饱和食盐水 | D. | 饱和食盐水、碱石灰 |
4.使5.6LCO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况下),这4.48L气体的质量为( )
| A. | 8.8g | B. | 6.4g | C. | 8.2g | D. | 6.2g |
14.相同温度下,容积相同的甲、乙两个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)?2SO3(g)+197kJ 实验测得有关数据如下:下列判断中正确的是( )
| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
| A. | 两容器中反应的平衡常数不相等 | |
| B. | 达到平衡时SO2的体积分数:甲<乙 | |
| C. | 197>Q1>Q2 | |
| D. | 生成1molSO3(l)时放出的热量等于98.5kJ |
1.下列事实,不能用氢键知识解释的是( )
| A. | 水和乙醇可以完全互溶 | |
| B. | 溴化氢比碘化氢稳定 | |
| C. | 干冰易升华 | |
| D. | 液态氟化氢的化学式有时可以写成(HF)n的形式 |
18.下列各有机物,互为同系物的是( )
| A. | 油酸与硬脂酸 | B. | 丙烯酸(CH2CHCOOH)与油酸 | ||
| C. | 甲酸与苯甲酸 | D. | 甲醇与乙二醇 |
19.下列化合物的电子式书写正确的是( )
| A. |  | B. |  | C. | 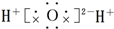 | D. | 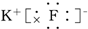 |