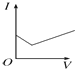
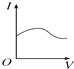
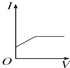
3.可以判定某酸是强电解质的组合是( )
①该酸加热至沸腾也不分解
②该酸可溶解氢氧化铜
③该酸可跟石灰石反应放出CO2
④该酸是共价化合物.
①该酸加热至沸腾也不分解
②该酸可溶解氢氧化铜
③该酸可跟石灰石反应放出CO2
④该酸是共价化合物.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | 都不是 |
2.能影响水的电离平衡,并使溶液中的[H+]>[OH-]的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加食盐晶体 |
1.下列说法正确的是( )
| A. | 水的电离方程式:H2O═H++OH- | B. | 升高温度,水的电离程度增大 | ||
| C. | 在NaOH溶液中没有H+ | D. | 在HCl溶液中没有OH- |
20.今有原子序数依次增大的A、B、C、D、E、F六种元素.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水.D和E各有如下表的电子层结构.在一般情况下,B元素不能与A、C、D、E元素的游离态化合而生成B的化合态.
按要求填空:
(1)各元素的元素符号分别为CAl,EP,D和E两者的氢化物稳定性较强的是PH3(填化学式).
(2)工业上制取单质D的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)A与C两元素的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)A和F形成的晶体中含有的化学键是离子键.
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| E | x+1 | x+4 |
(1)各元素的元素符号分别为CAl,EP,D和E两者的氢化物稳定性较强的是PH3(填化学式).
(2)工业上制取单质D的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)A与C两元素的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
(4)A和F形成的晶体中含有的化学键是离子键.
19.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有( )
| A. | ①②⑥ | B. | ②③⑥ | C. | ①③④⑤ | D. | 全部 |
17.某纯净物由两种原子构成,则该物质( )
| A. | 一定是化合物 | B. | 一定是单质 | ||
| C. | 可能是化合物,也可能是单质 | D. | 一定是同素异形体 |
16.(双选)关于氧化还原反应的下列说法中正确的是( )
| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
15.1.8g某金属在氯气中燃烧后,质量增加了7.1g,该金属是( )
0 166993 167001 167007 167011 167017 167019 167023 167029 167031 167037 167043 167047 167049 167053 167059 167061 167067 167071 167073 167077 167079 167083 167085 167087 167088 167089 167091 167092 167093 167095 167097 167101 167103 167107 167109 167113 167119 167121 167127 167131 167133 167137 167143 167149 167151 167157 167161 167163 167169 167173 167179 167187 203614
| A. | Ag | B. | Fe | C. | Al | D. | Na |