8.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 最高第二周期元素从左到右,正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
4.提纯下列物质(括号内少量杂质),所选用的除杂质试剂与分离方法正确的是( )
| 不纯物质 | 处杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙醇(水) | 新制生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
3.已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A. | XYZW的原子半径依次减小 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | W的最高价氧化物对应的水化物一定为强酸 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
2.下列组合中,中心离子的电荷数和配位数均相同的是( )
| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)2]Cl2 | D. | [Ni(NH3)4]Cl2、[Cu(NH3)4]SO4 |
1.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 氨气的相对分子质量大于甲烷 |
20.下列关于元素第一电离能的说法不正确的是( )
| A. | 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 | |
| B. | 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 | |
| C. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| D. | 对于同一元素而言,原子的逐级电离能越来越大 |
19.常温常压下,某气态烃和氧气的混合气体20L,完全燃烧后通过浓硫酸后,再恢复到原来条件,气体体积变为原来的一半.设烃完全燃烧无剩余,则该烃可能是( )
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
0 166954 166962 166968 166972 166978 166980 166984 166990 166992 166998 167004 167008 167010 167014 167020 167022 167028 167032 167034 167038 167040 167044 167046 167048 167049 167050 167052 167053 167054 167056 167058 167062 167064 167068 167070 167074 167080 167082 167088 167092 167094 167098 167104 167110 167112 167118 167122 167124 167130 167134 167140 167148 203614
①CH4 ②C2H4 ③C2H2 ④C2H6 ⑤C3H6 ⑥C3H4 ⑦C3H8 ⑧C4H6.
| A. | 只有①③④ | B. | ⑤⑥⑦⑧ | C. | 只有②⑦ | D. | ①②④⑦ |
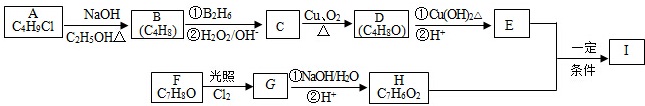
 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$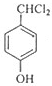 +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.
 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$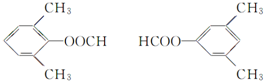 .
.