10.下列有关叙述正确的是( )
| A. | 离子化合物中一定含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 第IA族元素与第VIIA族可能形成离子化合物,也可能形成共价化合物 | |
| D. | 非金属元素间不可能形成离子化合物 |
9.只用一种试剂就能区别NaCl溶液、NaBr溶液、KI溶液、AgNO3溶液,该试剂是( )
| A. | 氯水 | B. | H2O | C. | 稀盐酸 | D. | NaOH溶液 |
8.下列物质中含有共价键的离子化合物的是( )
| A. | NaI | B. | CaCl2 | C. | CO2 | D. | KOH |
7.根据下列四种粒子的结构示意图,所获取的信息不正确的是( )
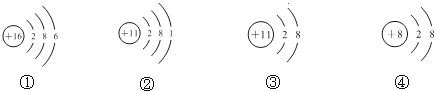
| A. | 它们表示三种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
6.某短周期元素的L层电子数是K层电子数的3倍,该元素的符号为( )
| A. | C | B. | S | C. | O | D. | Si |
5.已知A、B、C、D四种短周期主族元素,其相关信息如下:
①在元素周期表中的相对位置如下:
②B元素原子的最外层电子数为其核外电子总数的$\frac{2}{7}$,D的单质在空气中燃烧时,生成对环境有严重污染的气体.
请回答下列问题:
(1)D的元素符号为S,B的原子结构示意图为 .
.
(2)C的最高价氧化物对应水化物的化学式为H3PO4.
(3)下列说法中正确的是abc(填字母).
a.A的最高价氧化物对应的水化物在常温下可以和铜反应
b.B的最高价氧化物对应水化物钠盐的水溶液俗称水玻璃
c.常温下,D的最高价氧化物对应水化物的浓溶液可用铁制容器盛放
d.C的离子半径小于D的离子半径
(4)探究法是学习化学的重要方法之一.在下表中列出了对H2DO3各种不同化学性质的推测,根据示例完成下列表格:
①在元素周期表中的相对位置如下:
| A | ||
| B | C | D |
请回答下列问题:
(1)D的元素符号为S,B的原子结构示意图为
 .
.(2)C的最高价氧化物对应水化物的化学式为H3PO4.
(3)下列说法中正确的是abc(填字母).
a.A的最高价氧化物对应的水化物在常温下可以和铜反应
b.B的最高价氧化物对应水化物钠盐的水溶液俗称水玻璃
c.常温下,D的最高价氧化物对应水化物的浓溶液可用铁制容器盛放
d.C的离子半径小于D的离子半径
(4)探究法是学习化学的重要方法之一.在下表中列出了对H2DO3各种不同化学性质的推测,根据示例完成下列表格:
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2DO3+2H2D=3D↓+3H2O |
| ① | 酸性 | |
| ② | H2DO3+Br2+H2O=H2DO4+2HBr |
4.现有部分短周期元素的原子结构如下表:
(1)写出X的元素符号:N,Z元素原子的质量数为23.
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式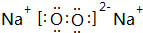 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.
(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
| 元素 编号 | 元素原子结构 |
| X | 原子结构示意图为 |
| Y | 最外层电子数是次外层电子数的2倍 |
| Z | 原子核内含有12个中子,且其离子的结构示意图为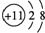 |
(2)元素Y的最高价氧化物的结构式为O=C=O,Z元素的单质在空气中燃烧产物的电子式
 ,用电子式表示X的气态氢化物的形成过程
,用电子式表示X的气态氢化物的形成过程 .
.(3)Y的最高价氧化物和Z元素的单质在空气中燃烧产物发生反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;若反应过程中,转移电子数为6.02×1023,则消耗Y的最高价氧化物的质量为1mol.
3.下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的是( )
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2=NaCl+NaClO+H2O | D. | NH3+CO2+H2O=NH4HCO3 |
2.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
1.氯化钠是日常生活中人们常用的调味品.是下列事实中,可以证明NaCl中一定存在离子键的是( )
0 166889 166897 166903 166907 166913 166915 166919 166925 166927 166933 166939 166943 166945 166949 166955 166957 166963 166967 166969 166973 166975 166979 166981 166983 166984 166985 166987 166988 166989 166991 166993 166997 166999 167003 167005 167009 167015 167017 167023 167027 167029 167033 167039 167045 167047 167053 167057 167059 167065 167069 167075 167083 203614
| A. | 水溶液能导电 | B. | 易溶于水 | C. | 熔化时能导电 | D. | 有较高的熔点 |