15.下列叙述中,正确的是( )
| A. | 氨水显碱性 | B. | 铵盐不易溶于水 | ||
| C. | 氨气可以用浓硫酸进行干燥 | D. | NH3+HCl═NH4Cl属于氧化还原反应 |
14.能清楚地反映甲烷分子里碳、氢原子的大小和相对空间位置的是( )
| A. | 结构式 | B. | 电子式 | C. | 比例模型 | D. | 分子式 |
13.稀土元素的物理性质和化学性质极为相似,常见化合价为+3价.在合金中加入适量稀土金属,能大大改善合金的性能,所以稀土元素又被称为冶金工业的维生素.其中钇(Y)元素是激光和超导的重要材料.我国蕴藏荇着丰富的含钇矿石(Y2FeBe2Si2O10).工业上通过如下生产流程可获得氧化钇.
已知:①有关金属离子形成氢氧化物沉淀时的pH如表:
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似.请回答下列问题:
(1)写出钇矿石与氢氧化钠共熔时的化学方程式4Y2FeBe2Si2O10+32NaOH+O2=8Y(OH)3+2Fe2O3+8Na2SiO3+8Na2BeO2+4H2O.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸和b两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)已知10-2.7=2×10-3、10-3.7=2×10-4,则25℃时,反应Fe3++3H2O?Fe(OH)3+3H+
的平衡常数K=8×10-5.如何检验Fe3+是否沉淀完全取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若观察不到血红色,则说明Fe3+沉淀完全(回答操作方法,不需设计所用仪器).
(4)①写出生成草酸钇沉淀的化学方程式2 Y(OH)2(s)+2H2C2O4(aq)=Y2(C2O4)3(s)+6H2O(l);
②若H2C2O4和湿润的KClO3混合加热到60℃可制得国际公认的高效含氯消毒剂ClO2,写出反应中氧化剂和氧化产物的物质的量之比1:1.在热水中ClO2会发生反应生成Cl2和HClO2,写出反应的化学方程式6ClO2+2H2O=Cl2+4HClO2+3O2.

已知:①有关金属离子形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)写出钇矿石与氢氧化钠共熔时的化学方程式4Y2FeBe2Si2O10+32NaOH+O2=8Y(OH)3+2Fe2O3+8Na2SiO3+8Na2BeO2+4H2O.
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则
①最好选用盐酸和b两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:BeO22-+4H+=Be2++2H2O.
(3)已知10-2.7=2×10-3、10-3.7=2×10-4,则25℃时,反应Fe3++3H2O?Fe(OH)3+3H+
的平衡常数K=8×10-5.如何检验Fe3+是否沉淀完全取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若观察不到血红色,则说明Fe3+沉淀完全(回答操作方法,不需设计所用仪器).
(4)①写出生成草酸钇沉淀的化学方程式2 Y(OH)2(s)+2H2C2O4(aq)=Y2(C2O4)3(s)+6H2O(l);
②若H2C2O4和湿润的KClO3混合加热到60℃可制得国际公认的高效含氯消毒剂ClO2,写出反应中氧化剂和氧化产物的物质的量之比1:1.在热水中ClO2会发生反应生成Cl2和HClO2,写出反应的化学方程式6ClO2+2H2O=Cl2+4HClO2+3O2.
12.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B 形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水为原料而获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
11.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图.下列有关说法错误的是( )


| A. | a极为负极,电极上发生氧化反应 | |
| B. | 电池总反应可表示为:2H2+O2═2H2O | |
| C. | 外电路中电子由b电极通过导线流向a电极 | |
| D. | 该装置工作时把电能转化为化学能 |
10.一定温度下,将 2mol SO2 和 1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,下列说法中正确的是( )
| A. | 达到反应限度时,生成 SO3 为2 mol | |
| B. | 达到反应限度时,反应放出 197 kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率 |
9.A元素原子的核电荷数为11,B元素的质子数为8,A和B化合形成化合物Z,下列说法中错误的是( )
| A. | A可以形成+1价阳离子 | B. | B的最高价为+6价 | ||
| C. | Z一定可以与水反应 | D. | Z中不可能含有共价键 |
8.已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如图.则下列判断错误的是( )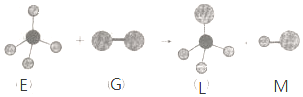

| A. | 常温常压下,E是一种无色无味的气体 | |
| B. | 干燥的G能漂白有色物质 | |
| C. | 在光照条件L能与 G继续发生与上述类似的反应 | |
| D. | 上述反应类型是取代反应 |
7.除去物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
6.下列实验操作中正确的是( )
0 163897 163905 163911 163915 163921 163923 163927 163933 163935 163941 163947 163951 163953 163957 163963 163965 163971 163975 163977 163981 163983 163987 163989 163991 163992 163993 163995 163996 163997 163999 164001 164005 164007 164011 164013 164017 164023 164025 164031 164035 164037 164041 164047 164053 164055 164061 164065 164067 164073 164077 164083 164091 203614
| A. |  向试管中滴加液体 | B. |  检查装置的气密性 | ||
| C. |  移走加热的蒸发皿 | D. |  加热液体 |