题目内容
12.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B 形成的气态化合物的水溶液呈碱性.下列说法正确的是( )| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水为原料而获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种元素.A、B形成的气态化合物的水溶液呈碱性,应为NH3,则A为H元素,B为N元素;D原子最外层电子数与最内层电子数相等,原子序数比N元素大,则D为Mg元素;B为N元素,B、C同周期,则C为第二周期元素,D为Mg元素,D与C形成的化合物是一种耐高温材料为MgO,则C为O元素;A、B、C、D的原子序数之和是1+7+8+12=28,是E的两倍,则E的原子序数为14,为Si元素.根据元素对应的单质、化合物的性质结合元素周期律知识解答该题.
解答 解:由分析可知:A为H元素,B为N元素,C为O元素,D为Mg元素,E为Si元素.
A.A为H元素,原子半径最小;同周期元素原子序数越大半径越小,B、C为N、O元素,位于第二周期,所以B>C,D、E为Mg、Si元素,位于第三周期,所以D>E;原子核外电子层数越多半径越大,硅原子半径大于碳原子半径,碳原子比较比氮原子半径大,所以有原子半径:D>E>B>C>A,故A正确;
B.由于非金属性:Si<O,非金属性越大,对应的氢化物越稳定,则热稳定性:SiH4<H2O,故B错误;
C.从海水中提取镁,通常将熟石灰加入海水中,沉淀出氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,电解熔融状态的氯化镁,就能制的金属镁,故C正确;
D.化合物MgO含有离子键,化合物SiO2中共价键,化学键类型不一样,故D错误.
故选AC.
点评 本题考查元素的推断、元素周期律以及对应元素化合物的性质,为高频考点,侧重考查学生的分析能力,题目难度不大,注意常见元素化合物的性质以及对应的工业用途.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
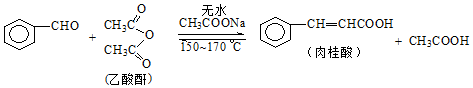
2. 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
空气冷凝管温度计
Ⅰ合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、5.3g苯甲醛和6.1g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴);不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解;.
(3)加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
Ⅱ粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
反应混合物加入饱和碳酸钠溶液蒸馏除去苯甲醛盐酸酸化操作I过滤、洗涤干燥肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是加热浓缩、冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是67.6%(保留三位有效数字).
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
Ⅰ合成:反应装置如图所示.向三颈烧瓶中先后加入研细的无水醋酸钠、5.3g苯甲醛和6.1g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴);不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解;.
(3)加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
Ⅱ粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

反应混合物加入饱和碳酸钠溶液蒸馏除去苯甲醛盐酸酸化操作I过滤、洗涤干燥肉桂酸晶体
(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是加热浓缩、冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是67.6%(保留三位有效数字).
3.常温下能用来盛放浓硝酸的金属器皿是( )
| A. | Na | B. | Mg | C. | Al | D. | Cu |
20.反应A+B=C+D的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为放热反应 | B. | 该反应吸收的能量为(E1-E2) | ||
| C. | 反应物A的能量低于生成物C的能量 | D. | 该反应只有在加热条件下才能进行 |
7.除去物质中所含少量杂质(括号内为杂质),所选用试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
17.浓硫酸在加热条件下能与金属铜发生反应,因为它具有( )
| A. | 吸水性 | B. | 催化性 | C. | 脱水性 | D. | 强氧化性 |
4.常温下pH=2的盐酸溶液和pH=12的NaOH溶液,下列叙述中不正确的是( )
| A. | 两溶液中水的电离程度相同 | |
| B. | 盐酸溶液中c(Cl-)等于NaOH溶液中c (Na+) | |
| C. | 若两溶液等体积混合能恰好中和 | |
| D. | 分别稀释10倍后,两溶液的pH之和大于14 |
1.某同学对“NaOH和NH4Cl都是离子化合物”,有下列四点感悟,其中不正确的是( )
| A. | 离子化合物中可能含共价键 | B. | 离子化合物中一定含离子键 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含共价键 |
2.N2O5是一种新型绿色硝化剂.用硼氢化钠(NaBH4)燃料电池做电源,电解法制备N2O5的装置简图如下(隔膜只允许H+ 通过).

回答下列问题:
(1)电池负极反应式是BH4-+8OH--8e-=BO2-+6H2O,电解池阳极生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
(2)隔膜不允许水分子通过的原因是H2O 通过隔膜进入阳极,与N2O5反应生成HNO3.N2O5在一定温度下可发生分解反应:2N2O5 (g)?2N2O4(g)+O2(g)△H>0,t℃时,向一定容积的密闭容器中通入N2O5(g),部分实验数据见下表:
(3)500s 时,c(O2)=1.375 mol?L-1.
(4)t℃时,该反应平衡常数K值为1.25.
(5)下列措施能降低N2O5分解率的是③④⑤.
①升温 ②通入N2 ③通入O2 ④通入N2O5 ⑤NO2.

回答下列问题:
(1)电池负极反应式是BH4-+8OH--8e-=BO2-+6H2O,电解池阳极生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
(2)隔膜不允许水分子通过的原因是H2O 通过隔膜进入阳极,与N2O5反应生成HNO3.N2O5在一定温度下可发生分解反应:2N2O5 (g)?2N2O4(g)+O2(g)△H>0,t℃时,向一定容积的密闭容器中通入N2O5(g),部分实验数据见下表:
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 2.25 | 2.50 | 2.50 |
(4)t℃时,该反应平衡常数K值为1.25.
(5)下列措施能降低N2O5分解率的是③④⑤.
①升温 ②通入N2 ③通入O2 ④通入N2O5 ⑤NO2.