2.下列说法正确的是( )
| A. | 难溶电解质的溶度积Ksp越小,则它的溶解度越小 | |
| B. | 任何难溶物在水中都可以存在沉淀溶解平衡,给定温度的溶解度大小都可以用Ksp计算出来 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小 |
1.利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用.其工作流程如图:

(1)铝热法冶炼金属铬,是利用了金属铝的还原性(填“氧化性”或“还原性”).
(2)溶液1中的阴离子有CrO42-、AlO2-、OH-.
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4mol CrO42-,消耗氧化剂的物质的量是0.3 mol.
(4)通入CO2调节溶液pH实现物质的分离.
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al.冶炼Al的化学方程式是2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$3O2↑+4Al.
②滤渣B受热分解所得物质可以循环利用,B是NaHCO3.
③已知:2CrO42-+2H+?Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是0.01mol/L.
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7.
不同温度下化合物的溶解度(g/100gH2O)
结合表中数据分析,过程Ⅱ得到K2Cr2O7粗品的操作是:向滤液③中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶,过滤得到K2Cr2O7粗品.

(1)铝热法冶炼金属铬,是利用了金属铝的还原性(填“氧化性”或“还原性”).
(2)溶液1中的阴离子有CrO42-、AlO2-、OH-.
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4mol CrO42-,消耗氧化剂的物质的量是0.3 mol.
(4)通入CO2调节溶液pH实现物质的分离.
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al.冶炼Al的化学方程式是2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$3O2↑+4Al.
②滤渣B受热分解所得物质可以循环利用,B是NaHCO3.
③已知:2CrO42-+2H+?Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是0.01mol/L.
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7.
不同温度下化合物的溶解度(g/100gH2O)
| 化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
11.乙炔广泛用于焊接、焊割及有机合成等方面.
(1)已知下列热化学方程式:
4CH4(g)+3O2═2C2H2(g)+6H2O(g)△H1=akJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H2═bkJ•mol-1
2CH4(g)═C2H2(g)+3H2(g)△H3
①△H3═$\frac{a-3b}{2}$(用含a、b的代数式表示)kJ•mol-1.
②已知下列共价键的键能数据:
则△H3═+468.4(填数值)kJ•mol-1.
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为2CHCl2+6Ag$→_{.}^{△}$HC≡CH↑+6AgCl
(3)向压强为1.0×104kPa的恒压密闭容器中充入1mol乙炔和1molHCl气体,在催化剂作用下乙炔与HCl发生反应:HC≡CH(g)+HCl(g)?CH2=CHCl(g),已炔的平衡转化率与温度的关系如图所示.

①该反应的△H<(填“>”或“<”)0,N点时乙炔的反应速率v(正)>(填“>”、“<”或“=”)v(逆).
②M点对应温度下,该反应的平衡常数Kp=2.4×10-3(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(KPa)-1.
(1)已知下列热化学方程式:
4CH4(g)+3O2═2C2H2(g)+6H2O(g)△H1=akJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H2═bkJ•mol-1
2CH4(g)═C2H2(g)+3H2(g)△H3
①△H3═$\frac{a-3b}{2}$(用含a、b的代数式表示)kJ•mol-1.
②已知下列共价键的键能数据:
| 共价键 | C-H | H-H | C≡C |
| 键能/kJ•mol-1 | 431.4 | 436 | 812 |
(2)氯仿(CHCl3)与金属银共热可以制取乙炔,该反应的化学方程式为2CHCl2+6Ag$→_{.}^{△}$HC≡CH↑+6AgCl
(3)向压强为1.0×104kPa的恒压密闭容器中充入1mol乙炔和1molHCl气体,在催化剂作用下乙炔与HCl发生反应:HC≡CH(g)+HCl(g)?CH2=CHCl(g),已炔的平衡转化率与温度的关系如图所示.

①该反应的△H<(填“>”或“<”)0,N点时乙炔的反应速率v(正)>(填“>”、“<”或“=”)v(逆).
②M点对应温度下,该反应的平衡常数Kp=2.4×10-3(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(KPa)-1.
9. 某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极),下列说法不正确的是( )
某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极),下列说法不正确的是( )
 某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极),下列说法不正确的是( )
某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极),下列说法不正确的是( )| A. | 电极a连接的是电源的正极 | |
| B. | 若电路中转移0.03mol e-,则离子交换膜左侧溶液中增加0.03mol离子 | |
| C. | 图中的离子交换膜是阳离子交换膜 | |
| D. | 阴极的电极反应式为2HSO3-+2e-+2H+═S2O42-+2H2O |
8.能正确表示下列反应的离子方程式是( )
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2--+6H+═2Mn2++5NO3-+3H2O |
6.1mol CH4与氯气发生取代反应,待反应完全后,测得四种产物的物质的量相等,则消耗氯气的物质的量是( )
| A. | 1.5mol | B. | 5mol | C. | 2.5mol | D. | 4mol |
5.下列说法正确的是( )
| A. | 离子化合物中不可能含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子单质分子里 | |
| D. | 金属元素和非金属元素形成的化合物中一定含有离子键 |
4.下列实验装置或操作不符合实验要求的是( )
0 163824 163832 163838 163842 163848 163850 163854 163860 163862 163868 163874 163878 163880 163884 163890 163892 163898 163902 163904 163908 163910 163914 163916 163918 163919 163920 163922 163923 163924 163926 163928 163932 163934 163938 163940 163944 163950 163952 163958 163962 163964 163968 163974 163980 163982 163988 163992 163994 164000 164004 164010 164018 203614
| A. |  除去粗盐水中的泥沙 | B. |  灼烧海带 | ||
| C. |  检验蔗糖是否水解 | D. | 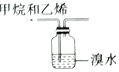 除去甲烷中的乙烯 |

