题目内容
【题目】锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
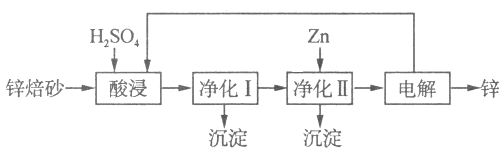
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
【答案】Ⅰ.(1)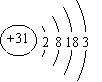 ;
;
(2) 2Ga + 2NH3 ![]() 2 GaN + 3H2 ;
2 GaN + 3H2 ;
(3) BCD;Ⅱ.(4)ZnFe2O4 + 4H2SO4![]() ZnSO4 + Fe2(SO4)3 + 4H2O ;
ZnSO4 + Fe2(SO4)3 + 4H2O ;
(5)Fe(OH)3胶粒具有吸附性;
(6)使Cu2+、Ni2+转化为Cu、Ni而除去;(7)pH >3.3。
【解析】
试题分析:(1)镓是31号元素,第IIIA族元素,原子结构示意图为: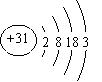 ;(2)GaN可由Ga和NH3在高温条件下制取,其反应方程式为:2Ga + 2NH3
;(2)GaN可由Ga和NH3在高温条件下制取,其反应方程式为:2Ga + 2NH3 ![]() 2 GaN + 3H2;(3)A、Ga跟铝属于同主族,和铝性质具有相似性,Ga(OH)3不溶于水,因此和水反应不剧烈,故错误;B、根据铝的性质,进行推测,故正确;C、氧化铝表形两性,Ga和Al属于同主族,性质具有相似,故正确;D、氢氧化铝受热分解成氧化铝和水,因此Ga(OH)3受热分解为Ga2O3,故正确;(4)ZnO和硫酸反应生成ZnSO4和水,Fe2O3和硫酸反应生成Fe2(SO4)3和水,因此反应方程式为:ZnFe2O4 + 4H2SO4
2 GaN + 3H2;(3)A、Ga跟铝属于同主族,和铝性质具有相似性,Ga(OH)3不溶于水,因此和水反应不剧烈,故错误;B、根据铝的性质,进行推测,故正确;C、氧化铝表形两性,Ga和Al属于同主族,性质具有相似,故正确;D、氢氧化铝受热分解成氧化铝和水,因此Ga(OH)3受热分解为Ga2O3,故正确;(4)ZnO和硫酸反应生成ZnSO4和水,Fe2O3和硫酸反应生成Fe2(SO4)3和水,因此反应方程式为:ZnFe2O4 + 4H2SO4![]() ZnSO4 + Fe2(SO4)3 + 4H2O ;(5)Fe(OH)3胶粒具有吸附性;(6)根据含有杂质以及净化I中沉淀为Fe(OH)3,溶液中含有Cu2+和Ni2+,因此加入锌的目的利用锌的金属性强,把Cu和Ni置换出,而除去;(7)假设c(Fe3+)=10-5mol·L-1,根据Ksp=c(Fe3+)×c3(OH-),解得c(OH-)=2×10-11mol·L-1,根据水的离子积,c(H+)=5×10-4mol·L-1,因此pH=3.3,控制pH的范围是pH>3.3。
ZnSO4 + Fe2(SO4)3 + 4H2O ;(5)Fe(OH)3胶粒具有吸附性;(6)根据含有杂质以及净化I中沉淀为Fe(OH)3,溶液中含有Cu2+和Ni2+,因此加入锌的目的利用锌的金属性强,把Cu和Ni置换出,而除去;(7)假设c(Fe3+)=10-5mol·L-1,根据Ksp=c(Fe3+)×c3(OH-),解得c(OH-)=2×10-11mol·L-1,根据水的离子积,c(H+)=5×10-4mol·L-1,因此pH=3.3,控制pH的范围是pH>3.3。