题目内容
【题目】下列物质中,含有非极性键的共价化合物是()
A.Na2O2 B.CH3CH3 C.NaCl D.N2
【答案】B
【解析】
试题分析:A.Na2O2中含有离子键和非极性键,则为含有非极性键的离子化合物,故A不选;B.CH3CH3中含有C-C非极性键,C-H极性键,则为含有非极性键的共价化合物,故B选;C.NaCl中只含有离子键,故C不选;D.N2中只含有非极性共价键,属于单质,故D不选;故选B。

【题目】下列根据实验事实所作结论中,正确的是( )
实验事实 | 结论 | |
A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 |
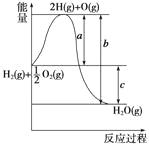
【题目】汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.0 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
2C(s)+2O2(g)=2CO2(g) △H=-787.0 kJ/mol
则尾气转化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= 。
N2(g)+2CO2(g) △H= 。
(2)对于反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表
N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-4 mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
c(CO)/×10-4 mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率 υ(CO2)= mol/(Ls)。
②在该温度下,反应的平衡常数K= 。
(3)假设在恒容密闭容器中发生上述反应,下列有关说法正确的是 。
A.选用更有效的催化剂能提高尾气的转化率
B.升高反应体系的温度能提高反应速率, 提高尾气的转化率
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4 mol/L和2.00×10-4 mol/L,平衡时N2的体积分数比原平衡体系中N2的体积分数低
D.单位时间内消耗NO的物质的量等于生成CO2的物质的量时即达平衡状态

(4)用尾气NO2为原料可制新型硝化剂N2O5,原理:先将NO2转化为N2O