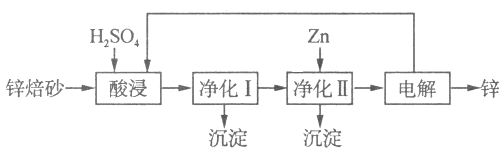
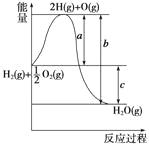
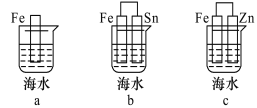
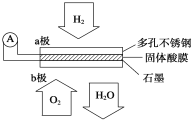
题目内容
【题目】I.某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
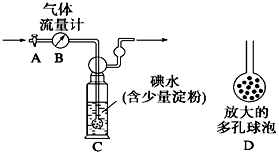
⑴ C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是 。
⑵ C中发生反应的离子方程式 。
⑶ C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
II.实验室常用Na2SO3固体与浓硫酸反应制取SO2 :
⑷ 现有已制得SO2的饱和溶液,请利用此溶液(其他试剂任选),设计一个简单实验,比较SO2与Fe2+ 还原性的强弱(要求:写出实验步骤、现象和结论) 。
⑸ 某研究小组测定部分变质的Na2SO3固体样品中Na2SO3的含量:
① 取a克Na2SO3固体样品配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,0.0100mol/L碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
② 计算:样品中亚硫酸钠的质量分数为 。
【答案】⑴ 增大气体与溶液的接触面积,有利于SO2与碘水反应(或被碘水充分吸收);⑵ SO2 + I2 +2H2O = SO42—+ 2I— + 4H+ ;⑶ 偏低;⑷ 取约2mLSO2的饱和溶液于试管中,滴加3~5滴氯化铁溶液,摇匀,滴加2~3滴KSCN溶液,溶液不变红,再滴加几滴BaCl2溶液,产生白色沉淀,说明还原性 SO2>Fe2+;⑸ ① 溶液恰好由无色变蓝色,且30秒蓝色不褪去;② ![]() 。
。
【解析】
试题分析:(1)多孔球泡增大与液面的接触面积,有利于SO2和碘水的反应;(2)I2具有强氧化性能把SO2氧化成SO42-,根据化合价的升降法进行配平,因此离子反应方程式为:SO2 + I2 +2H2O = SO42-+ 2I- + 4H+ ;(3)如果没有及时关闭活塞,通入尾气的体积增大,测的SO2的含量偏低;(4)比较还原性强弱,可以采用氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,或还原剂的还原性强于还原产物的还原性,因此利用2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+ ,设计:取约2mLSO2的饱和溶液于试管中,滴加3~5滴氯化铁溶液,摇匀,滴加2~3滴KSCN溶液,溶液不变红,再滴加几滴BaCl2溶液,产生白色沉淀,说明还原性 SO2>Fe2+;(5)①利用淀粉遇碘单质变蓝,因此滴定的终点:溶液恰好由无色变蓝色,且半分钟不褪去;②发生的离子反应方程式为:H2O + I2 + SO32- = 2I- + SO42- + 2H+ ,n(Na2SO3) = 20 × 10-3 × 0.01 × 100/10 mol = 2 × 10-3 mol,亚硫酸的质量分数:2 × 10-3 × 126/a × 100% = 0.252/a × 100%。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
【题目】下列根据实验事实所作结论中,正确的是( )
实验事实 | 结论 | |
A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 |