题目内容
【题目】某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如下:

(1)仪器a的名称为______。
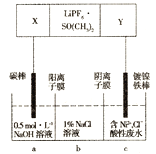
(2)B装置中盛放的试剂是______,C中发生反应的化学方程式为_______。
(3)通过______(填实验现象),可判断碳的非金属性强于硅的非金属性。请你再列举出一条事实,说明碳的非金属性强于硅的非金属性:______。
(4)该小组的一位同学认为,利用此实验装置及药品,也可以证明非金属性Cl>C>Si,你是否同意该同学的观点?___(填“同意”或“不同意”)。
【答案】分液漏斗 饱和NaHCO3溶液 Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ C中有白色胶状沉淀生成 CH4比SiH4稳定或碳单质与氢气化合比硅单质与氢气化合容易 不同意
【解析】
根据实验装置特点及强酸制弱酸的原理分析解答。
(1)根据图示,仪器a的作用是加入药品,仪器名称为分液漏斗;
(2)根据实验原理,B装置目的是除去二氧化碳中混有的HCl气体,其中盛放的试剂是饱和NaHCO3溶液;二氧化碳与硅酸钠溶液反应的化学方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓;
(3)通过实验装置分析,A装置生成二氧化碳气体,经过B装置除杂后,通过硅酸钠溶液中,若生成白色难溶的硅酸,说明碳酸酸性强于硅酸,所以现象为:C中有白色胶状沉淀生成;还可以根据元素周期律来比较元素的非金属性,如:CH4比SiH4稳定或碳单质与氢气化合比硅单质与氢气化合容易;
(4)实验中通过盐酸与碳酸钙反应制备二氧化碳气体,说明盐酸的酸性强于碳酸,但盐酸是Cl的氢化物,碳酸是C的最高价含氧酸,不能通过酸性强弱比较元素的非金属性,所以该同学的观点是错误的。

【题目】在下列影响化学反应速率的因素中,能使化学反应速率加快的方法是( )
①升高温度 ②加入催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末
A. ①②③ B. ①②④ C. ①③④ D. ①②③④
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。