题目内容
9.下列关于卤素的叙述,正确的是( )| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 卤化银的溶解度随核电荷数的增加逐渐增大 | |
| C. | 单质与水反应均可表示为X2+H2O═HX+HXO | |
| D. | 随核电荷数的增加,X-的半径递增,还原性递减 |
分析 A.卤族元素单质的颜色随着核电荷数增大而加深;
B.卤化银的溶解度随着核电荷数的增大而减小;
C.除了氟气外,卤素单质与水反应均可表示为X2+H2O═HX+HXO;
D.随着核电荷数的增大,X-的半径递增,还原性递增.
解答 解:A.卤族元素单质随着核电荷数增大,其颜色分别是淡黄绿色、黄绿色、红棕色、紫红色,所以卤族元素单质的颜色随着核电荷数增大而加深,故A正确;
B.卤化银的溶解度随着核电荷数的增大而减小,氯化银能转化为溴化银或碘化银,溴化银能转化为碘化银,故B错误;
C.除了氟气外,卤素单质与水反应均可表示为X2+H2O═HX+HXO,氟气和水反应方程式为2F2+2H2O=4HF+O2,故C错误;
D.随着核电荷数的增大,X-的半径递增,其原子核对最外层电子的吸引力减小,所以还原性递增,故D错误;
故选A.
点评 本题以卤族元素为载体考查同一主族元素结构及性质递变规律,为高频考点,注意规律中的异常现象,易错选项是C.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
19.A元素原子的第2层比B元素原子的第2层少3个电子,B元素的原子核外电子总数比A元素原子的核外电子总数多5个,则A与B可形成的化合物类型为( )
| A. | AB | B. | BA2 | C. | AB4 | D. | B3A2 |
20.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 气体35Cl2的摩尔质量为70 | |
| D. | 3.5g的气体35Cl2的体积为2.24L |
17.可在有机物中引入羟基的反应类型是( )
①取代 ②加成 ③消去 ④酯化 ⑤还原.
①取代 ②加成 ③消去 ④酯化 ⑤还原.
| A. | ①③⑤ | B. | ①②⑤ | C. | ①④⑤ | D. | ①②③ |
4.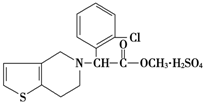 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )
 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来希望.波立维属于硫酸氢盐,它的结构如图所示.下列关于它的说法正确的是( )| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质不溶于水 | |
| C. | 波立维属于硫酸氢盐,它的形成与其结构中的氮原子有关 | |
| D. | 它可以与NaOH溶液反应,1 mol该物质最多可消耗2 mol NaOH |
14.下列说法正确的是( )
| A. | 凡是卤代烃一定能发生消去反应 | |
| B. | 酯化反应中一般是羧酸脱去羧基中的羟基,醇脱去羟基上的氢原子 | |
| C. | 浓H2SO4在酯化反应中只起催化剂的作用 | |
| D. | 欲使酯化反应生成的酯分离并提纯,可以将弯导管伸入饱和Na2CO3溶液的液面下,再用分液漏斗分离 |
1.某化工废液中可能含有下列微粒:Al3+、Fe3+、NO2-、甘油分子.某化学兴趣小组的同学设计了下列实验验证这些微粒的存在,下列说法不正确的是( )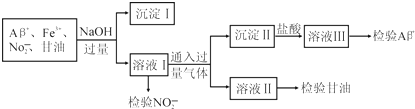
已知:Al3++6F-═[AlF6]3-.

已知:Al3++6F-═[AlF6]3-.
| A. | 通入的过量气体可能是CO2 | |
| B. | 分离出沉淀Ⅰ的操作名称是过滤,利用沉淀Ⅰ可检验出Fe3+ | |
| C. | 若向溶液Ⅲ中先加足量NH4F后再加氨水可以检验Al3+ | |
| D. | 用酸性KI溶液检验NO2-离子的离子方程式为2NO2-+2I-+4H+═2NO+I2+2H2O |
19.已知Br2在有机溶剂中的溶解度比在水中的大,下列有机溶剂能从溴水中萃取溴的是( )
| A. | 酒精 | B. | 乙酸 | C. | 四氯化碳 | D. | 汽油 |