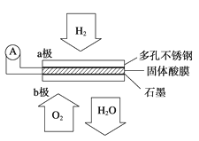
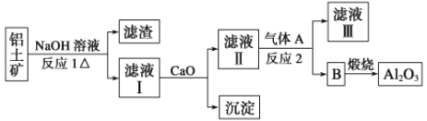
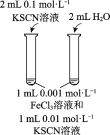
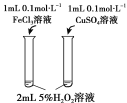
题目内容
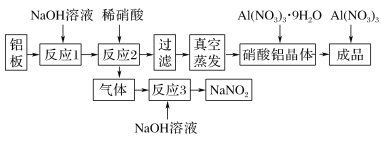
【题目】向500~600℃的铁屑中通入氯气生产无水氯化铁,现用如图所示的装置进行实验,下列说法正确的是

A.分液漏斗中盛放的试剂是稀盐酸
B.洗气瓶中盛放的试剂是饱和食盐水
C.应先点燃I中酒精灯,再点燃III中酒精灯
D.烧杯中盛放石灰水,目的是吸收尾气
【答案】C
【解析】
装置I是制备氯气的发生装置,生成的氯气中含氯化氢和水蒸气,通过装置Ⅱ中浓硫酸干燥氯气,通过装置Ⅲ反应生成无水氯化铁,剩余气体通过Ⅳ氢氧化钠溶液吸收。
A. 装置I是制备氯气的发生装置,原料是二氧化锰和浓盐酸,分液漏斗中盛放的试剂是浓盐酸,故A错误;
B. 通过装置Ⅱ中浓硫酸干燥氯气,洗气瓶中盛放的试剂是浓硫酸,故B错误;
C. 应先点燃I中酒精灯,产生氯气,排除装置中的空气,再点燃III中酒精灯,故C正确;
D. 剩余气体通过Ⅳ氢氧化钠溶液吸收,不用石灰水,碱的浓度太低,故D错误;
故选C。

【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
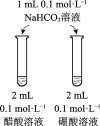
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
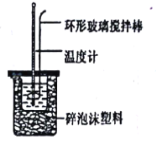
【题目】实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 26.9 |
完成下列问题:
(1)根据上表中所测数据,该实验中和热△H=___。(不必计算和化简,代入数据即可)[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
(2)在该实验过程中,该同学需要测定的实验数据有___(填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度