题目内容
【题目】为了充分利用铜资源,某工厂拟用黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下:
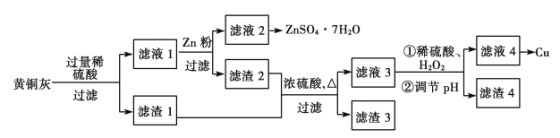
(1)滤渣1的主要成分为__________。稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应的离子方程式是_______________________
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是________,实验室通常用__________溶液吸收。
(3)稀硫酸通过浓硫酸稀释得到,稀释浓硫酸的正确操作方法是_____________________。过滤操作所需玻璃仪器除玻璃棒外还有_______________________
(4)用惰性电极电解滤液4可制取金属铜,若制得金属铜12.8 g,则同时阳极得到______L气体(标准状况)。
【答案】(1)Cu和SiO2 2Fe3++Cu===2Fe2++Cu2+
(2)SO2 NaOH
(3)将浓硫酸沿烧杯内壁缓缓注入蒸馏水中,同时不断地用玻璃棒搅拌 烧杯、漏斗
(4)2.24 L
【解析】根据题给信息和生产流程知黄铜灰加入过量稀硫酸发生的反应为Zn+2H+===Zn2++H2↑、ZnO+2H+===Zn2++H2O、CuO+2H+===Cu2++H2O、FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O、2Fe3++Cu===2Fe2++Cu2+,过滤,滤渣1的主要成分为Cu和SiO2,滤液1为硫酸锌、硫酸铜、硫酸亚铁的混合液;向滤液1中加锌粉发生的反应为Zn+Fe2+===Fe+Zn2+、Zn+Cu2+===Cu+Zn2+,过滤,滤液2为硫酸锌溶液,滤渣2为铁、铜混合物;铁、铜和二氧化硅的混合物与浓硫酸混合加热生成硫酸铜、硫酸铁和硫酸亚铁及二氧化硫和水,过滤,滤渣3为二氧化硅,滤液3为硫酸铜、硫酸铁和硫酸亚铁的混合液,加入稀硫酸、H2O2后亚铁离子被氧化为铁离子,调节pH,铁离子转化为氢氧化铁沉淀,过滤,滤渣4为氢氧化铁,滤液4为硫酸铜溶液,处理后得铜单质。
(1)滤渣1的主要成分为Cu和SiO2。稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的氧化还原反应的离子方程式是:2Fe3++Cu===2Fe2++Cu2+。
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是SO2,实验室通常用NaOH溶液吸收。
(3)稀释浓硫酸的正确操作方法是将浓硫酸沿烧杯内壁缓缓注入蒸馏水中,同时不断地用玻璃棒搅拌。过滤操作所需玻璃仪器除玻璃棒外还有烧杯、漏斗。
(4)滤液4为硫酸铜溶液,用惰性电极电解硫酸铜溶液发生的反应为2Cu2++2H2O2Cu+O2↑+4H+,若制得金属铜12.8 g,则同时阳极得到氧气0.1 mol,标准状况下的体积为2.24 L气体。