题目内容
(6分)下列七种晶体:
(1)由原子直接构成的分子晶体是__________。
(2)含有非极性键的分子晶体是____________,含有离子键、共价键的化合物是___________。
(3)在一定条件下能导电且导电时未发生化学反应的是______________,受热熔化需克服共价键的是__________________,受热熔化后化学键不发生变化的是__________。
| A.二氧化硅 | B.乙烷晶体 | C.碳酸钠 | D.氯化钠 E.晶体氩F.过氧化氢 G.镁(用字母填空) |
(2)含有非极性键的分子晶体是____________,含有离子键、共价键的化合物是___________。
(3)在一定条件下能导电且导电时未发生化学反应的是______________,受热熔化需克服共价键的是__________________,受热熔化后化学键不发生变化的是__________。
(6分) (1)E (2)BF C (3) G A BF(每空1分,不全对不给分)
分子晶体有:B、E和F;原子晶体有:A;离子晶体包括C、D;金属晶体包括:G
(1)氩是单原子分子,分子之间由范德华作用力,选E
(2)乙烷CH3CH3中含有C—C非极性键,过氧化氢H2O2中含有O—O非极性键,均为分子晶体;
只要含有离子键,必属于离子离子晶体,碳酸钠阴离子中含有非金属原子之间的共价键,选C
(3)金属导电时不发生化学反应,故选镁符合条件
原子晶体受热熔化时需要克服共价键,选二氧化硅符合题意
受热熔化后化学键不发生变化的是分子晶体,故乙烷、过氧化氢符合题意
(1)氩是单原子分子,分子之间由范德华作用力,选E
(2)乙烷CH3CH3中含有C—C非极性键,过氧化氢H2O2中含有O—O非极性键,均为分子晶体;
只要含有离子键,必属于离子离子晶体,碳酸钠阴离子中含有非金属原子之间的共价键,选C
(3)金属导电时不发生化学反应,故选镁符合条件
原子晶体受热熔化时需要克服共价键,选二氧化硅符合题意
受热熔化后化学键不发生变化的是分子晶体,故乙烷、过氧化氢符合题意

练习册系列答案
相关题目

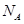 的表达式为 。
的表达式为 。