题目内容
(15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式 。
⑵钾、钙、镓的第一电离能从大到小的顺序是 。
⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。
⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。
⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。
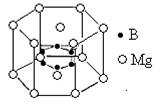
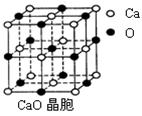
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式 。
⑵钾、钙、镓的第一电离能从大到小的顺序是 。
⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。
⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。
⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。

⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
(15分)
⑴4s24p1 (2分) ⑵钙>镓>钾(2分)
⑶>(1分) 由于两晶体的晶格能:氟化钠大于溴化钠。(1分)
⑷任选两个作答。★锂和镁在过量的氧气中燃烧均生成氧化物,而不是过氧化物。★锂、镁都能与氮气直接化合而生成氮化物。★锂、镁与水反应均较缓慢。★锂、镁的氢氧化物都是中强碱,溶解度都不大,在加热时分解为Li2O和MgO。★锂、镁的碳酸盐均难溶于水。(2分) 对角线规则(2分)
⑸平面正三角形 sp3 B (3分) ⑹MgB2 (2分)
⑴4s24p1 (2分) ⑵钙>镓>钾(2分)
⑶>(1分) 由于两晶体的晶格能:氟化钠大于溴化钠。(1分)
⑷任选两个作答。★锂和镁在过量的氧气中燃烧均生成氧化物,而不是过氧化物。★锂、镁都能与氮气直接化合而生成氮化物。★锂、镁与水反应均较缓慢。★锂、镁的氢氧化物都是中强碱,溶解度都不大,在加热时分解为Li2O和MgO。★锂、镁的碳酸盐均难溶于水。(2分) 对角线规则(2分)
⑸平面正三角形 sp3 B (3分) ⑹MgB2 (2分)
略

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
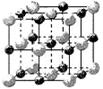

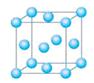
 mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是
mol(N2分子中的键能为942kJ/mol),晶体结构如图所示。下列有关高聚氮的说法不正确的是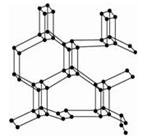
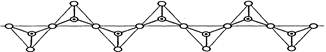
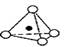 ,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子:
,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子: