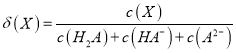题目内容
【题目】下表是不同温度下水的离子积数据:

试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”),作此判断的理由是______。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L﹣1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)在t2℃下,pH=10的NaOH溶液中,水电离产生的OH-为浓度为_________。
(4)t2℃下,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=________。
(5)有H+浓度相同、体积相等的三种酸:a、盐酸 b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率大小顺序为_____;反应完全后生成H2的质量大小关系为____(用abc表示酸)。
【答案】 > 温度升高,Kw变大 103 10-10 9:11 a=b=c a=b<c
【解析】本题考查考查水的电离、水的离子积常数和pH的有关计算。(1)水是弱电解质,存在电离平衡,电离吸热;所以温度升高,水的电离程度增大,离子积增大;(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中c(Na+)=1×10-3mol/L.取该溶液1mL此溶液,钠离子浓度仍为1×10-3mol/L,稀释10倍,则钠离子浓度是1×10-4mol/L.但硫酸钠溶液是显中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1;(3)在t2℃下,pH=10的NaOH溶液,c(H+)=1×10-10mol/L,水电离产生的OH-浓度为c(OH-)水=c(H+)水=1×10-10mol/L;(4)根据题意,t2℃下,即Kw=1×10-12,pH=11的NaOH溶液中OH-的物质的量浓度为c(OH-)=10-1,混合后pH=2,即酸过量,根据计算公式得∶![]() ,解得V1:V2= 9:11;(5)H+浓度大小影响生成氢气的反应速率,H+浓度相同,则开始时的反应速率相同,即a=b=c;醋酸为弱酸,不能完全电离,则H+浓度相同时酸的浓度最大,盐酸和硫酸都为强酸,H+浓度相同、溶液体积相同,则H+物质的量相同,则完全反应后生成H2的体积由大到小是c>a=b。
,解得V1:V2= 9:11;(5)H+浓度大小影响生成氢气的反应速率,H+浓度相同,则开始时的反应速率相同,即a=b=c;醋酸为弱酸,不能完全电离,则H+浓度相同时酸的浓度最大,盐酸和硫酸都为强酸,H+浓度相同、溶液体积相同,则H+物质的量相同,则完全反应后生成H2的体积由大到小是c>a=b。

【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
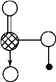
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。

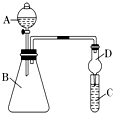
【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:


A B C D E
(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
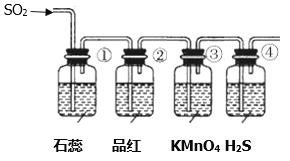
(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0g Na2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是________________________,样品中Na2SO3质量分数是_______。