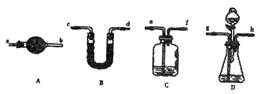
题目内容
以下实验能获得成功的是( )
| A.用酸性KMnO4溶液鉴别乙烯和乙炔 |
| B.将铁屑、溴水、苯混合制溴苯 |
| C.在苯和硝基苯采用分液的方法分离 |
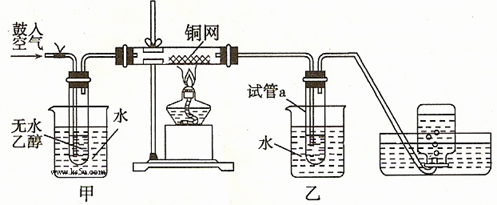
| D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
D
考查物质的鉴别。乙烯和乙炔都能使酸性高锰酸钾溶液褪色,A不正确。苯和液溴在催化剂的作用下生成溴苯,而不是溴苯,B不正确。苯和硝基苯互溶,不能直接分液,C不正确。氧化铜在加热的条件下能把乙醇氧化生成乙醛,而氧化铜被还原生成铜,所以正确的答案是D。

练习册系列答案
相关题目
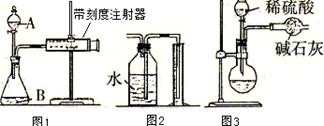
 2CrO42-+2H+左移,导致滴定终点滞后。
2CrO42-+2H+左移,导致滴定终点滞后。
 。(填写化学式或分子式)
。(填写化学式或分子式) 
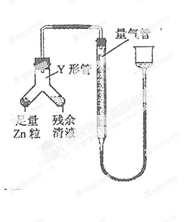
 NaCl杂质,为测
NaCl杂质,为测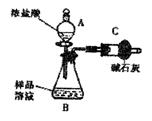
 可重复使用,夹持仪器略)
可重复使用,夹持仪器略)