题目内容
(16分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①测定上述实验用的Fe(NO3)3溶液的pH值 | |
| ② |
(16分)(1)c (2分)
(2)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡(2分) 溶液的紫红色褪去(2分)(或其它方法,但操作要与现象一致,否则只给操作分)
Fe3++Ag= Fe2++Ag+ (2分)
(3)4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O(2分)
(2)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡(2分) 溶液的紫红色褪去(2分)(或其它方法,但操作要与现象一致,否则只给操作分)
Fe3++Ag= Fe2++Ag+ (2分)
(3)4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O(2分)
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① | 若银镜消失,假设②成立。(2分) 若银镜不消失,假设②不成立。(2分) |
| ②配制相同pH值的稀硝酸溶液,并将适量此溶液加入有银镜的试管内(2分) |
(1)ab中均会产生污染性气体,且原料利用率不高。选项c中产生的污染性气体最少,原料利用率高,答案选c。
(2)亚铁离子的检验常用酸性高锰酸钾溶液溶液,即)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡,溶液的紫红色褪去,即说明含有亚铁离子。铁离子氧化单质银的方程式为Fe3++Ag= Fe2++Ag+。
(3)在酸性条件下NO3-能氧化Ag,反应的方程式为4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O。由于乙同学放弃了检验NO3-在不同条件下的还原产物的方法,所以可以通过配制相同pH的硝酸溶液来和银反应,从而检验在此酸性条件下NO3-是不是能氧化Ag。
(2)亚铁离子的检验常用酸性高锰酸钾溶液溶液,即)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡,溶液的紫红色褪去,即说明含有亚铁离子。铁离子氧化单质银的方程式为Fe3++Ag= Fe2++Ag+。
(3)在酸性条件下NO3-能氧化Ag,反应的方程式为4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O。由于乙同学放弃了检验NO3-在不同条件下的还原产物的方法,所以可以通过配制相同pH的硝酸溶液来和银反应,从而检验在此酸性条件下NO3-是不是能氧化Ag。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
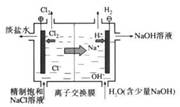

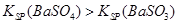
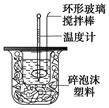
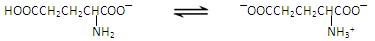
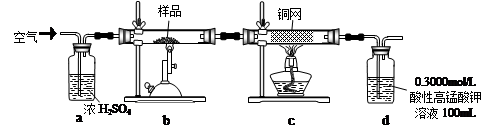
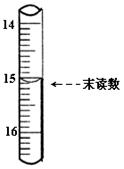
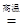 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。