下图装置测定中和热的实验步骤如下:
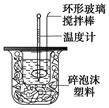
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应,表示中和热的热化学方程式(中和热数值为57.3 kJ/mol)
。
(2)倒入NaOH溶液的正确操作是
(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是
(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
| 温度差平均值(t2-t1)/℃
|
H2SO4
| NaOH
| 平均值
|
1
| 26.2
| 26.0
| 26.1
| 29.5
|
|
2
| 25.9
| 25.9
| 25.9
| 29.2
|
3
| 26.4
| 26.2
| 26.3
| 29.8
|
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm
3,中和后生成溶液的比热容
c=4.18 J/(g·℃),则中和热Δ
H=
(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时平视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后,用另一支温度计测定H
2SO
4溶液的温度

 初中暑期衔接系列答案
初中暑期衔接系列答案
 + 6HCHO = 3H++ 6H2O + (CH2)6N4H+
+ 6HCHO = 3H++ 6H2O + (CH2)6N4H+
 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。