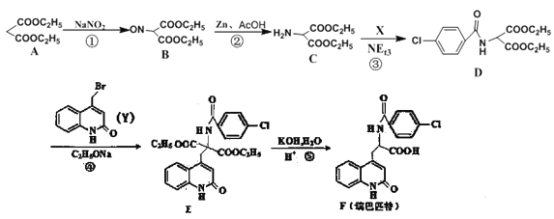
题目内容
【题目】下列关于热化学反应的描述中正确的是( )
A. 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含74.0 g Ca(OH)2的稀溶液与稀硫酸完全中和,放出57.3 kJ的热量
B. 已知N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1,将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1mol NH3(g),放出46.2kJ的热量
2NH3(g) △H=-92.4kJ·mol-1,将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1mol NH3(g),放出46.2kJ的热量
C. 2gH2完全燃烧生成液态水放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D. 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+1/2O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
【答案】B
【解析】
A.中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,74.0gCa(OH)2的稀溶液与稀硫酸完全中和生成2mol水,应放出114.6kJ的热量,故A错误;
B.由N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1可知,完全反应生成2mol的NH3(g),放出92.4kJ的热量,所以将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1molNH3(g),放出46.2kJ的热量,故B正确;
2NH3(g) △H=-92.4kJ·mol-1可知,完全反应生成2mol的NH3(g),放出92.4kJ的热量,所以将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1molNH3(g),放出46.2kJ的热量,故B正确;
C.ΔH的单位为kJ·mol-1,所以氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,故C错误;
D.燃烧热是指1mol可燃物完全燃烧生成稳定的化合物所放出的热量,甲醇燃烧生成的氢气不属于稳定的化合物,故D错误。