题目内容
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为___________
②A和B的核电荷数之差为____________(用含m、n的代数式表示)
③B和A的族序数之差为______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。回答下列问题:
①如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为_____________;当B在A的下一周期时,B的原子序数为______________;
②如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________当B在A的下一周期时,B的原子序数为______________。
(3)某粒子的结构示意图为: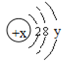 试回答:
试回答:
①当x-y=10时,该粒子为________(填“原子”或“阳离子”“阴离子”)
②当y=8时,该粒子可能是(写名称):_______、________、_______、_______、_______。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式________________。
【答案】1 m+n 8-n-m x-n x+m x-m x+n 原子 氩原子 氯离子 硫离子 钾离子 钙离子) Al(OH)3+3H+=Al3++3H2O
【解析】
(1)①因Am+和Bn-核外电子排布相同,故A原子比B原子多一个电子层,故二者的周期数之差为1,故答案为:1;
②电子排布相同,则电子数相同,即ZA-m=ZB+n,则ZA-ZB=m+n,故答案为:m+n;
③B的负价为-n,则最高正价为8-n,即B的族序数为8-n,而A的族序数为m,B和A的族序数之差为8-n-m,故答案为:8-n-m;
(2)①A、B同在ⅠA族,当B在A的上一周期时,B和A的原子序数之差恰好为B所在周期的元素种类数,则B的原子序数为x-n;当B在A的下一周期时,A和B的原子序数之差恰好为A所在周期的元素种类数,则B的原子序数为x+m,故答案为:x-n;x+m;
②A、B同在ⅦA族时,A、B原子序数之差恰好为相邻两周期下一周期的元素种类数,与A、B同在ⅠA族相反,如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为x-m,当B在A的下一周期时,B的原子序数为 x+n,故答案为:x-m;x+n;
(3)①当x-y=10时,核内质子数为x,核外电子数为2+8+y,两者相等,所以该粒子为原子,故答案为:原子;
②当y=8时,该微粒的核外电子数为18,而离子中核内质子数不等于核外电子数,则该粒子的核内质子数为:20、19、18、17、16等,所以这些粒子为氩原子、氯离子、硫离子、钾离子、钙离子,故答案为:氩原子;氯离子;硫离子;钾离子;钙离子;
③y=3与y=7的元素最高价氧化物对应水化物分别为Al(OH)3和HClO4,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案