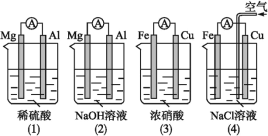
��Ŀ����
����Ŀ��W��M��X��Y��Z�����ڱ�ǰ36��Ԫ���е����ֳ���Ԫ�أ���ԭ��������������W��һ�ֺ����ڿ���ʱ����������һЩ����������M���������ǵ����������Ҫ����֮һ��X��ijһ�ֵ����Ǵ�����Ⱦ������֮һ��Y�Ļ�̬ԭ�Ӻ�����6��ԭ�ӹ�����ڰ����״̬��Z���γɺ�ɫ��Z2O�ͺ�ɫ��ZO���������
��1��Y3����̬�ĵ����Ų�ʽ�ɱ�ʾΪ ��
��2��MX3���Ŀռ乹�� ����������������
��3��M���γɶ����⻯�����MH3�ļ���ǿ��M2H4��ԭ���� ��
��4�����ݵȵ���ԭ����WX���ӵĽṹʽΪ ��
��5��1 mol WX2�к��е�������ĿΪ ��
��6��H2X������Xԭ�ӹ�����ӻ�����Ϊ ��
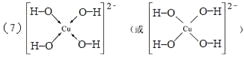
��7����Z2+����Һ�м������NaOH��Һ��������Z����λ��Ϊ4����λ���ӣ�д������λ���ӵĽṹʽ ��
���𰸡���1��1s22s22p63s23p63d3����[Ar]3d3��(2��)
��2��ƽ��������(2��)
��3��N2H4������NΪ-2�ۣ���NH3������NΪ-3�ۣ������Ը��ߣ�����Nԭ�ӵŶԵ��Ӹ����ṩ������H+��ϣ��ʼ��Ը�ǿ��(3��)
��4��C��O (2��)
��5��2��6.02��1023������2NA��(2��)
��6��sp3(2��)
 (2��)
(2��)
��������
���� W��M��X��Y��Z�����ڱ�ǰ36��Ԫ���е����ֳ���Ԫ�أ���ԭ��������������W��һ�ֺ����ڿ���ʱ����������һЩ����������W��CԪ�أ�M���������ǵ����������Ҫ����֮һ��M��NԪ�أ�X��ijһ�ֵ����Ǵ�����Ⱦ������֮һ����X��OԪ�أ�Y�Ļ�̬ԭ�Ӻ�����6��ԭ�ӹ�����ڰ����״̬����Y�ļ۵����Ų�Ϊ3d54s1,����Y��Cr��Z���γɺ�ɫ��Z2O�ͺ�ɫ��ZO���������Z��Cu�����ԣ�1��Y3����̬�ĵ����Ų�ʽ�ɱ�ʾΪ1s22s22p63s23p63d3��2��NO3�������У�N�ļ۲���Ӷ���Ϊ3+1/2(5+1-3��2)=3,�¶Ե��ӣ�����MX3���Ŀռ乹��Ϊƽ���������Σ���3���ӻ��ϼ۽Ƕ�N2H4������NΪ-2�ۣ���NH3������NΪ-3�ۣ������Ը��ߣ�����Nԭ�ӵŶԵ��Ӹ����ṩ������H+��ϣ��ʼ��Ը�ǿ����4��CO�뵪���ǵȵ����壬�ṹ���ƣ�����CO�Ľṹʽ�����ڵ��������������ṹ���ṹʽΪC��O��
��5��CO2�����д���2��̼��˫����ÿ��˫������1������������1molCO2�����д���2NA��2��6.02��1023��������;��6��H2O�����У�O�ļ۲���Ӷ�����2+1/2(6-2)=4����Oԭ���ӻ�����Ϊsp3�ӻ�����7����Cu2+�������NaOH��Һ�����������ǻ���ͭ�����ӣ��ṹʽΪ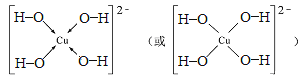

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵���������
A.��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50��
B.��Ӧ�ɱ�ʾΪX(g)+3Y(g)2Z(g)����ƽ�ⳣ��Ϊ1600
C.�ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
D.�ı�ѹǿ��ƽ�ⳣ�����䣬ƽ�ⲻ�ƶ�
����Ŀ���¶�T��ʱ����3��1L�ĺ����ܱ������з�����C0(g)+H20(g)= C02(g) + H2(g) ��H =-41kJmol-1,����ʼʱͶ�ϵķ�ʽ�������ʵ��������ƽ�������ϵ�����ı仯���±���ʾ��
������� | ��ʼ���������ʵ���/mol | ��ƽ�������ϵ�����ı仯����Ϊ��ֵ�� | |||
C0 | H20(g) | C02 | H2 | ||
�� | 1 | 4 | 0 | 0 | 32.8kJ |
�� | 8 | 2 | 0 | 0 | Q1 |
�� | 0 | 0 | 1 | 4 | Q2 |
����˵������ȷ����
A. ������10s�������з�Ӧ�ﵽƽ�⣬��v(CO)=0.08molL-1s-1
B. �����ں��������������仯��Q2=Q1=32.8kJ
C. ������������ı��˸÷�Ӧ��;������Ӧ�ġ�HҲ��֮�ı�
D. ������ͬ��������ƽ�������������ټ���0.2molCO(g)��0.8molCO2(g) ����ƽ�ⲻ�����ı�