题目内容
8.有下列物质:①0.5 mol NH3,②16gO2,③4℃时9mL H2O,④0.2 mol H2SO4.所含原子数由多到少顺序排列的是①③④②.分析 结合n=$\frac{m}{M}$计算物质的量,由N=nNA及物质的构成可知,原子的物质的量越大,其数目越多,以此来解答.
解答 解:①0.5 mol NH3含有原子的物质的量为0.5mol×4=2mol;
②16gO2中原子的物质的量为:$\frac{16g}{32g/mol}$×2=1mol;
③4℃9mL 水,n(H2O)=$\frac{9g}{18g/mol}$=0.5mol,原子的物质的量为0.5mol×3=1.5mol;
④0.2mol H2SO4含有原子的物质的量为0.2mol×7=1.4mol,
所以由大到小顺序排列①③④②,
故答案为:①③④②.
点评 本题考查物质的量的有关计算,为高频考点,把握有关物质的量为中心的基本计算公式为解答的关键,侧重计算能力及分析能力的考查,题目难度不大.

练习册系列答案
相关题目
18.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证.以下类推的结论正确的是( )
| A. | 不能用电解AlCl3来制取Al,也不能用电解MgCl2来制取镁 | |
| B. | 金刚石的硬度大,则C60的硬度也大 | |
| C. | Zn能与稀硫酸反应生成氢气,故Zn与稀硝酸反应也生成氢气 | |
| D. | Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
19.对于反应:2Na2O2+2CO2═2Na2CO3+O2,被氧化的氧原子与被还原的氧原子的个数之比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:2 |
16.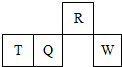 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断错误的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物的水化物能与氨水反应 |
3.请你完成下表中1-8处的空白.
①98g/mol,②1mol,③18,④6.0201×1023,⑤17g/mol,⑥1mol,⑦56,⑧6.0200×1023.
| 物质及其质量 | 相对原子质量或相对分子质量 | 摩尔质量 | 物质的量 | 一个粒子的质量 | 所含粒子的数目 |
| 98gH2SO4 | 98 | ① | ② | 1.628×10-22g | 6.0197×1023 |
| 18gHN4+ | ③ | 18g/mol | l mol | 2.9900×10-23g | ④ |
| 17gOH- | 17 | ⑥ | ⑥ | 2.8239×10-23g | 6.0200×1023 |
| 56gFe | ⑦ | 56g/mol | l mol | 9.3023×10-23g | ⑧ |