题目内容
【题目】中学化学中几种常见物质的转化关系如图K8﹣4所示.将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.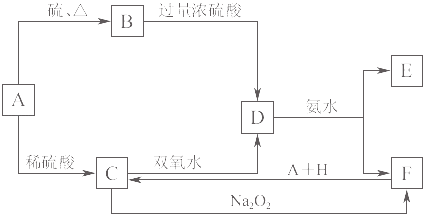
请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围: .
(2)A,B,H的化学式:A、B、H .
(3)①H2O2分子的电子式为 .
②写出C的酸性溶液与双氧水反应的离子方程式: .
(4)写出鉴定E中阳离子的实验方法和现象: .
(5)在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式: .
【答案】
(1)1nm﹣100nm
(2)Fe,FeS,H2SO4
(3)![]() ,2Fe2++H2O2+2H+═2Fe3++2H2O
,2Fe2++H2O2+2H+═2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝
(5)4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+
【解析】解:将D溶液滴入沸水中可得到以F为分散质的红褐色液体,说明F为Fe(OH)3;证明D为硫酸铁,E为硫酸铵;由转化关系可知,C为硫酸亚铁,推断A为Fe;B为FeS,转化关系中F(Fe(OH)3)+H+A(Fe)=C(FeSO4),推断H为硫酸;根据判断出的物质回答问题:综上所述各物质为:A、Fe;B、FeS;C、FeSO4;D、Fe2(SO4)3;E、(NH4)2SO4;F、Fe(OH)3;H、H2SO4;
(1)红褐色液体是氢氧化铁胶体,分散质粒子直径大小的范围是1nm﹣100nm,
所以答案是:1nm﹣100nm;
(2)依据推断可知A为Fe,B的化学式为:FeS,H为H2SO4;
所以答案是:Fe,FeS,H2SO4;
(3)①分析判断H2O2是共价化合物,分子的电子式为: ![]() ;
;
所以答案是: ![]() ;
;
②C的酸性溶液与双氧水反应,是FeSO4的溶液(A→C稀硫酸过量)与双氧水在酸性溶液中反应,亚铁离子被过氧化氢氧化为三价铁,过氧化氢被还原为水,离子方程式:
2Fe2++H2O2+2H+═2Fe3++2H2O,
所以答案是:2Fe2++H2O2+2H+═2Fe3++2H2O;
(4)E中有铵根离子,可取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝,说明有铵根离子,
所以答案是:取少量E于试管中,用胶头滴管加入溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝;(5)在C(FeSO4)溶液中加入与C等物质的量的Na2O2,恰好使C转化为F(Fe(OH)3),反应的离子方程式为:4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+;
所以答案是:4Fe2++4Na2O2+6H2O═4Fe(OH)3+O2↑+8Na+;

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案