题目内容
【题目】将1molCO和1molH2O充入容器中,在催化剂存在下发生反应H2O (g)+CO(g)H2 (g)+CO2(g)达到平衡时,发现有50%的CO转化为CO2 . 在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,则反应达平衡后,求:
(1)达平衡后CO的转化率
(2)混合气体中CO2体积分数.
【答案】
(1)解:达到平衡时,发现有50%的CO转化为CO2,则转化的CO为1mol×50%=0.5mol,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 1 | 1 | 0 | 0 | |
转化 | 0.5 | 0.5 | 0.5 | 0.5 | |
平衡 | 0.5 | 0.5 | 0.5 | 0.5 |
则K= ![]() =1,
=1,
在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,设转化的CO为x,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 3 | 1 | 0 | 0 | |
转化 | x | x | x | x | |
平衡 | 3﹣x | 1﹣x | x | x |
则K= 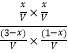 =1,解得x=0.75mol
=1,解得x=0.75mol
达平衡后CO的转化率为 ![]() ×100%=75%,
×100%=75%,
答:CO的转化率为75%;
(2)解:混合气体中CO2体积分数为 ![]() ×100%=18.75%,答:CO2体积分数为18.75%
×100%=18.75%,答:CO2体积分数为18.75%
【解析】达到平衡时,发现有50%的CO转化为CO2 , 则转化的CO为1mol×50%=0.5mol,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 1 | 1 | 0 | 0 | |
转化 | 0.5 | 0.5 | 0.5 | 0.5 | |
平衡 | 0.5 | 0.5 | 0.5 | 0.5 |
则K= ![]() =1,
=1,
在其他条件不变的情况下,若将1molCO和3molH2O充入反应器中,设转化的CO为x,则
H2O (g)+ | CO(g) | H2 (g)+ | CO2(g) | ||
开始 | 3 | 1 | 0 | 0 | |
转化 | x | x | x | x | |
平衡 | 1﹣x | x | x |
则K= 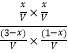 =1,解得x=0.75mol,以此来解答.
=1,解得x=0.75mol,以此来解答.
【考点精析】掌握化学平衡常数的含义和化学平衡的计算是解答本题的根本,需要知道指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 名校课堂系列答案
名校课堂系列答案【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
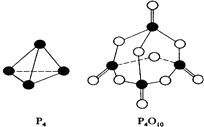
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
【题目】碘在科研与生活中有重要应用.某兴趣小组用0.50molL﹣1KI、0.2%淀粉溶液、0.20molL﹣1K2S2O8、0.10molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知: S2O82﹣+2I﹣═2SO42﹣+I2(慢) I2+2S2O32﹣═2I﹣+S4O62﹣(快)
(1)向KI,Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积/mL溶液 | ||||
K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | V1 | V3 | 4.0 | 2.0 |
③ | 8.0 | V2 | V4 | V5 | 2.0 |
表中V3、V4和V5取实验设计的体积数值,目的是 , 表中的V2= , 理由是 .