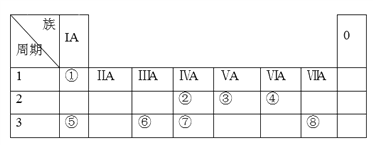
题目内容
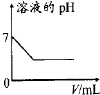
【题目】把金属钠投入下列物质的稀溶液中,溶液质量会减轻的是
A.HClB.FeCl3C.Na2SO4D.NaOH
【答案】B
【解析】
A.发生反应:2Na+2HCl=2NaCl+ H2↑.溶液的质量会增加。错误。
B.首先发生反应:2Na+ 2H2O =2NaOH+H2↑;然后发生反应:FeCl3+3NaOH= Fe(OH)3↓+3NaCl。溶液质量增加的小于减轻的,因此会减轻,正确。
C.在Na2SO4溶液中会发生反应:2Na+2H2O=2NaOH+H2↑;溶液的质量会增加。错误。
D.在NaOH的溶液中会发生反应:2Na+2H2O=2NaOH+H2↑;溶液的质量会增加。错误。
故选B。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】根据题意解答
(1)CH3﹣CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
化学键 | C﹣H | C=C | C﹣C | H﹣H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热△H= .
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S) . 已知断裂下列化学键需要吸收的能量分别为如下
化学键 | P﹣P | P﹣O | P=O | O﹣O | O=O |
键能(kJ/mol) | a | b | c | d | e |
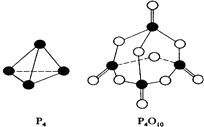
根据图示的分子结构和有关数据估算该反应的△H=;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气. 已知:①N2(g)+2O2(g)=N2O4(1)△H1=﹣195.0kJmol﹣1
②N2H4(1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4反应的热化学方程式 .
【题目】碘在科研与生活中有重要应用.某兴趣小组用0.50molL﹣1KI、0.2%淀粉溶液、0.20molL﹣1K2S2O8、0.10molL﹣1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知: S2O82﹣+2I﹣═2SO42﹣+I2(慢) I2+2S2O32﹣═2I﹣+S4O62﹣(快)
(1)向KI,Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的耗尽后,溶液颜色将由无色变成为蓝色.其中该反应速率快慢的是由(填“第一个”或“第二个”)反应决定的.为确保能观察到蓝色,S2O32﹣与S2O82﹣初始的物质的量需满足的关系为:n(S2O32﹣):n(S2O82﹣) .
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积/mL溶液 | ||||
K2S2O8溶液 | H2O | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | V1 | V3 | 4.0 | 2.0 |
③ | 8.0 | V2 | V4 | V5 | 2.0 |
表中V3、V4和V5取实验设计的体积数值,目的是 , 表中的V2= , 理由是 .