题目内容
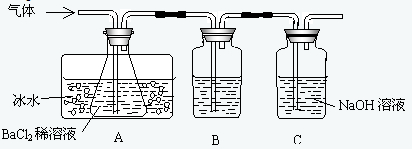
(10分)工业上用固体硫酸亚铁制取Fe2O3,反应原理是: 2FeSO4Fe2O3 +SO2 ↑+SO3 ↑某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量(已知SO2沸点为- 10. 02℃)
请回答相关问题:
(1)Fe2O3俗称为 不溶于水而易溶于酸,Fe2O3与稀盐酸反应的离子方程式为
(2)A瓶所盛试剂的作用是 C瓶所盛试剂的作用是
,用冷水冷却的原因是 ;B瓶所盛的试剂是
(3)将此反应生成的气体通入A瓶的BaCI2溶液中,下列说法正确的是 (填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
理由是
(4)在用固体硫酸亚铁制取Fe2O3的反应中,还原产物是 ,标准状况下每生成11. 2L SO2气体,转移电子的物质的量为 mol.
(1)铁红;Fe2O3 +6H+ =Fe3++3H2O
(2)检验并吸收SO3; SO3与H2O反应放出大量的热;品红溶液;吸收SO2
(3)B、D;SO3溶予水形成H2SO4,H2SO4与BaCl2反应生成BaSO4,SO2在冰水中溶解度小,与BaCl2不反应
(4) SO2;1
解析:

 每日10分钟口算心算速算天天练系列答案
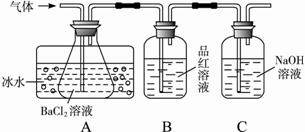
每日10分钟口算心算速算天天练系列答案工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)X溶液、(Ⅲ)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
| A.(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| B.可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C.(Ⅱ)所盛X可为品红溶液 |
| D.(Ⅲ)的作用是吸收有毒的SO2气体 |