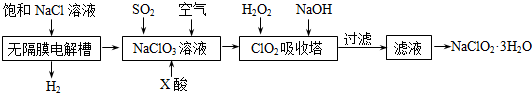
题目内容
11.设计如下装置进行试验(已知PdCl2能被CO还原得到黑色的Pb).
(1)A装置还能制备的气体是bd.
a.二氧化锰与浓盐酸制氯气 b.碳化钙与水制乙炔
c.氢氧化钙与氯化铵制氨气 d.铜与浓硝酸制二氧化氮
(2)B装置中的药品是饱和的碳酸氢钠溶液,检查装置的气密性并装好药品后,D处酒精灯点燃的条件是装置⑤中产生白色沉淀.
(3)请利用实验室常用仪器、用品和以下限选试剂完成Na在CO2中充分燃烧后D中残留固体成分的探究过程.限选试剂:pH试纸、稀HCl、NaOH溶液、澄清石灰水、BaCl2溶液、蒸馏水.
分析 (1)装置A是气体发生装置,属于固体和液体不加热制备气体的装置,据此分析选项;
(2)要保证实验成功,应该先制备二氧化碳,用二氧化碳排尽装置内的空气,当e装置中产生白色沉淀,说明空气中的二氧化碳排尽,再加热d处的酒精灯发生反应;氯化氢与碳酸氢钠溶液反应生成二氧化碳,用饱和碳酸氢钠溶液吸收氯气中挥发的氯化氢杂质;
(3)反应生成物可能是碳酸钠、碳、氧化钠等固体,依据实际和物质性质设计实验验证.
解答 解:(1)装置A是气体发生装置,属于固体和液体不加热制备气体的装置,
a.二氧化锰与浓盐酸制氯气需要加热反应,故a错误;
b.碳化钙与水制乙炔 是固体和液体不加热的反应符合装置要求,故b正确;
c.氢氧化钙与氯化铵制氨气需要加热反应生成氨气,故c错误;
d.铜与浓硝酸制二氧化氮是装置固体和液体不加热反应生成气体,符合装置要求,故d正确,
故选bd;
(2)由分析可知,反应需要排尽装置内的空气,当装置⑤中产生白色沉淀,说明空气中的二氧化碳排尽,再加热d处的酒精灯发生反应;从发生装置内制备的氯气含有氯化氢气体,通过盛有饱和食盐水的装置④可以除去氯化氢;
故答案为:饱和的碳酸氢钠溶液;装置⑤中产生白色沉淀;
(3)Na在CO2中充分燃烧后D中残留固体成分的探究过程为:取少量装置4中的残留固体溶于水,若有黑色不溶颗粒,则说明残留固体中有碳;在所得水溶液中再加入过量BaCl2溶液,若有沉淀生成,则说明残留固体中有Na2CO3;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
故答案为:取少量装置4中的残留固体溶于水,若有黑色不溶颗粒,则说明残留固体中有碳;在所得水溶液中再加入过量BaCl2溶液,若有沉淀生成,则说明残留固体中有Na2CO3;过滤,用pH试纸检验滤液,若滤液呈碱性,则残留固体中含有Na2O.
点评 本题考查了一眼探究和物质性质的分析,气体制备装置选择,掌握实验基本操作是解题关键,题目难度中等.

①只含一种元素的物质一定是纯净物
②BaSO4是一种难溶于水的强电解质
③冰醋酸、烧碱、小苏打分别属于酸、碱、盐
④铁位于元素周期表中第四周期第ⅧB族
⑤不能通过化合反应制得FeCl2和Fe(OH)3.
| A. | ②③④ | B. | ①③ | C. | ②③ | D. | ①②⑤ |
| A. | 氯水 | B. | 碘酒 | C. | HI水溶液 | D. | 溴蒸气 |
| A. | 第15列元素原子的最外层电子排布为ns2 np5 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第9列元素是铁元素 | |
| D. | 第9列中元素中没有非金属元素 |
| A. | 金属铝溶于NaOH溶液:Al+4OH-=[Al(OH)4]- | |
| B. | 向AlCl3溶液中加入足量氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ | |
| C. | Na2SiO3溶液中通入过量CO2:CO2+H2O+SiO32-=H2SiO3↑+CO32- | |
| D. | 向Na[Al(OH)4]溶液中加入过量的盐酸:[Al(OH)4]-+4H+=Al3++4H2O |