题目内容
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
(1)Si在元素周期表中的位置为
性强弱为
(2)上表元素中,原子半径最小的是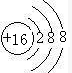
 .
.
(3)能证明Br2比I2的氧化性强的事实是
(1)Si在元素周期表中的位置为
第三周期ⅣA
第三周期ⅣA
,根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱为
H3PO4>H3AsO4
H3PO4>H3AsO4
.(2)上表元素中,原子半径最小的是
F
F
,画出硫离子结构示意图

(3)能证明Br2比I2的氧化性强的事实是
Br2+2NaI=2NaBr+I2
Br2+2NaI=2NaBr+I2
(用化学方程式表示).| C | N | O | F | ||
| Si | P | S | Cl | ||
| Ge | As | Se | Br | ||
| Sn | Sb | Te | I | ||
分析:(1)Si的原子结构示意图中有3个电子层,最外层电子数为4;同主族随原子序数的增大,非金属性减弱,则对应最高价含氧酸的酸性减弱;
(2)电子层数越少,半径越小,同周期中,原子序数越大其原子半径越小;S的质子数为16;
(3)利用单质之间的置换反应比较氧化性的强弱.
(2)电子层数越少,半径越小,同周期中,原子序数越大其原子半径越小;S的质子数为16;
(3)利用单质之间的置换反应比较氧化性的强弱.
解答:解:(1)Si的原子结构示意图中有3个电子层,最外层电子数为4,则位于元素周期表中第三周期ⅣA;同主族随原子序数的增大,非金属性减弱,则对应最高价含氧酸的酸性减弱,非金属性P>As,所以酸性为H3PO4>H3AsO4,
故答案为:第三周期ⅣA;H3PO4>H3AsO4;
(2)电子层数越少,半径越小,同周期中,原子序数越大其原子半径越小,则以上元素中原子半径最小的为F,S的质子数为16,其离子结构示意图为, ,
,
故答案为:F;
(3)利用单质之间的置换反应比较氧化性的强弱,如Br2+2NaI=2NaBr+I2,故答案为:Br2+2NaI=2NaBr+I2.
故答案为:第三周期ⅣA;H3PO4>H3AsO4;
(2)电子层数越少,半径越小,同周期中,原子序数越大其原子半径越小,则以上元素中原子半径最小的为F,S的质子数为16,其离子结构示意图为,
 ,
,故答案为:F;
(3)利用单质之间的置换反应比较氧化性的强弱,如Br2+2NaI=2NaBr+I2,故答案为:Br2+2NaI=2NaBr+I2.
点评:本题考查元素周期表和元素周期律的应用,注意同周期、同主族元素的性质变化规律是解答本题的关键,注意氧化性的比较方法,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



