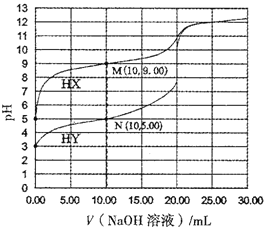
题目内容
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________。
②由上表数据可知该反应为放热反应,理由是_________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
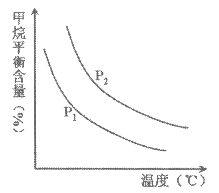
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________。
②该温度下反应的平衡常数K值为_________。
【答案】![]()
![]()
![]() 随温度升高,反应的平衡常数K减小 a、d < 吸热 60%
随温度升高,反应的平衡常数K减小 a、d < 吸热 60% ![]() 或2.25
或2.25
【解析】
(1)①工业合成氨的化学方程式为:![]()
![]()
![]() ;
;
②对于放热反应而言,升高温度,K值减小,表中的数据表明升高温度,K值在减小,所以可以推出该反应是放热反应;
③a. 增大压强,平衡向正反应方向(气体体积减小的方向)移动移动,则H2的转化率增大,a正确;
b. 催化剂不影响平衡的移动,不会引起H2的转化率的改变,b错误;
c. 升高温度,平衡向逆反应方向(吸热反应方向)移动,则H2的转化率减小,c错误;
d. 及时分离出NH3,则NH3的浓度减小,平衡正向移动,H2的转化率增大,d正确;
故合理选项为a、d;
(2)①温度相同时,压强由P1变为P2,CH4的平衡含量升高,说明平衡逆向移动,由于该反应的逆反应是气体体积减小的反应,所以压强增大,即P1<P2;
②压强相同时,升高温度,CH4的平衡含量降低,说明平衡正向移动,则该反应是吸热反应;
(3)该反应的三段式为(单位:mol·L-1):
CO (g)+ | H2O(g) | CO2(g)+ | H2(g) | |
1 | 1 | 1 | 1 | |
起 | 0.2 | 0.2 | 0 | 0 |
转 | 0.12 | 0.12 | 0.12 | 0.12 |
平 | 0.08 | 0.08 | 0.12 | 0.12 |
①CO的转化率为![]() =60%;
=60%;
②K=![]() =
=![]() =2.25。
=2.25。

【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
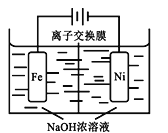
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。