题目内容
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
【答案】 ![]() sp2、sp3 C D E G H 平面三角形 O>N>Co>K CrO2 CH4(SiH4)、NH4+ 4
sp2、sp3 C D E G H 平面三角形 O>N>Co>K CrO2 CH4(SiH4)、NH4+ 4 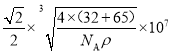 (或
(或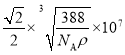 )
)
【解析】试题分析:本题考查物质结构与性质,主要考查价电子排布图的书写,电负性的比较,杂化方式和VSEPR模型的判断,化学键的类型,等电子体的书写,配位数的确定,晶体的计算。
(1)①铁的原子序数为26,基态铁原子核外电子数为26,根据构造原理,基态铁原子的核外电子排布式为[Ar]3d64s2,则Fe3+的核外电子排布式为[Ar]3d5,Fe3+的价电子排布式为3d5,Fe3+的价电子排布式图为![]() 。
。
②此配离子中-C2H5和-CH3中碳原子为sp3杂化,“C=O”和“C=C”中碳原子为sp2杂化,此配离子中碳原子的杂化类型为sp3杂化、sp2杂化。
③根据配离子的结构知,乙酰乙酸乙酯中碳碳之间存在非极性键,碳氢、碳氧、氧氢之间存在极性键,单键中只有σ键,碳碳双键和碳氧双键中存在σ键和π键,Fe3+与乙酰乙酸乙酯之间存在配位键,此配离子中含有的化学键为极性键、非极性键、配位键、σ键和π键,答案选CDEGH。
(2)NO2-中中心原子N的孤电子对数为![]() (5+1-2
(5+1-2![]() 2)=1,成键电子对数为2,价层电子对数为1+2=3,NO2-的VSEPR模型为平面三角形。元素的非金属性越强电负性越大,元素的金属性越强电负性越小,则四种元素的电负性由大到小的顺序为O
2)=1,成键电子对数为2,价层电子对数为1+2=3,NO2-的VSEPR模型为平面三角形。元素的非金属性越强电负性越大,元素的金属性越强电负性越小,则四种元素的电负性由大到小的顺序为O![]() N
N![]() Co
Co![]() K。
K。
(3)V2O5中金属阳离子为V5+,V5+的核外电子排布式为1s22s22p63s23p6,没有未成对电子;CrO2中金属阳离子为Cr4+,Cr4+的核外电子排布式为1s22s22p63s23p63d2,3d上有2个未成对电子;根据“金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好”,适合作录音带磁粉原料的是CrO2。
(4)用替换法,与BH4-互为等电子体的分子为CH4、SiH4,离子为NH4+等。
(5)由晶胞可见b的配位数为4,该晶体的化学式为ZnS,则a的配位数也为4。用“均摊法”,晶胞中含a:8![]() +6
+6![]() =4,含b:4,设晶胞的边长为x,则晶胞的体积为x3,1mol晶体的体积为
=4,含b:4,设晶胞的边长为x,则晶胞的体积为x3,1mol晶体的体积为![]() NA,1mol晶体的质量为(32+65)g=97g,1mol晶体的体积为
NA,1mol晶体的质量为(32+65)g=97g,1mol晶体的体积为![]() ,
, ![]() NA=
NA=![]() ,解得x=
,解得x=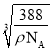 cm。根据晶胞相邻2个b微粒之间的距离为面对角线的一半,相邻2个b微粒之间的距离为
cm。根据晶胞相邻2个b微粒之间的距离为面对角线的一半,相邻2个b微粒之间的距离为![]() x=
x=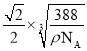 cm=
cm=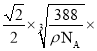 107nm。
107nm。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式______________________(中和热ΔH=-57.3 kJ/mol)。
L-1硫酸滴定,写出该中和反应的热化学方程式______________________(中和热ΔH=-57.3 kJ/mol)。
(2)将该烧碱样品配成500mL待测溶液需要的玻璃仪器有________________________。
(3)滴定过程中,眼睛应注视_________________________,若用酚酞作指示剂达到滴定终点颜色变化是______________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________molL-1,烧碱样品的纯度是___________。
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____________。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果____________。