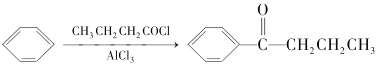
题目内容
【题目】硫、氮、磷等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为________。
(2)常见含硫的物质有![]() ,
,![]() ,
,![]() ,该三种物质中熔点最高的是________(填化学式)。
,该三种物质中熔点最高的是________(填化学式)。
(3)将过量的![]() 通入
通入![]() 溶液中可以得到
溶液中可以得到![]() ,
,![]() 中第一电离能最大的是________(填元素符号)。
中第一电离能最大的是________(填元素符号)。![]() 、
、![]() 和
和![]() 的价电子对数均为4,但键角不同,其原因是________。
的价电子对数均为4,但键角不同,其原因是________。
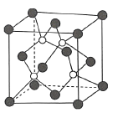
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应得到。磷化硼晶体的晶胞结构如图所示,该晶胞中含有________个B原子。已知该晶胞的边长为![]() ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为![]() ,则磷化硼晶体的密度为________
,则磷化硼晶体的密度为________![]() 。
。
【答案】1s22s22p63s13p33d1 ![]() N 中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小 4
N 中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小 4 ![]()
【解析】
(1)根据基态P的核外电子排布式分析书写;
(2)根据晶体类型分析判断;
(3)根据第一电离能的变化规律分析,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小;
(4)根据晶胞结构分析,P原子占据晶胞的顶点和面心,为面心立方最密堆积,B在晶胞内,根据ρ=![]() 计算晶体密度。
计算晶体密度。
(1)磷是15号元素,基态P原子的核外电子排布式为1s22s22p63s23p3,磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为1s22s22p63s13p33d1。故答案为:1s22s22p63s13p33d1;
(2)![]() 和
和![]() 属于分子晶体,
属于分子晶体,![]() 属于离子晶体,离子键的强度远大于分子间作用力,该三种物质中熔点最高的是
属于离子晶体,离子键的强度远大于分子间作用力,该三种物质中熔点最高的是![]() 。故答案为:
。故答案为:![]() ;
;
(3)将过量的![]() 通入
通入![]() 溶液中可以得到
溶液中可以得到![]() ,
,![]() 中铜是金属,第一电离能最小,氮的2p轨道是半充满状态,能量较低,体系较稳定,而氧的2p却易失一个电子,变为半充满状态,第一电离能N大于O,O和S同主族,第一电离能O大于S,第一电离能S大于H,第一电离能最大的是N。
中铜是金属,第一电离能最小,氮的2p轨道是半充满状态,能量较低,体系较稳定,而氧的2p却易失一个电子,变为半充满状态,第一电离能N大于O,O和S同主族,第一电离能O大于S,第一电离能S大于H,第一电离能最大的是N。![]() 中心原子碳上没有孤电子对,键角最大,
中心原子碳上没有孤电子对,键角最大,![]() 中心原子氮上有一对孤电子对,键角略小,
中心原子氮上有一对孤电子对,键角略小,![]() 中心原子氧上有二对孤电子对,键角最小;
中心原子氧上有二对孤电子对,键角最小;![]() 、
、![]() 和
和![]() 的价电子对数均为4,但键角不同,其原因是中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小。故答案为:N;中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小;
的价电子对数均为4,但键角不同,其原因是中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小。故答案为:N;中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小;
(4)由磷化硼晶体的晶胞结构图可知,该晶胞中含有4个B原子,P原子占据晶胞的顶点和面心,一个晶胞中含有P的个数为8×![]() +6×
+6×![]() =4个,不妨取1mol这样的晶胞,则有NA个这样的晶胞,1mol晶胞的质量为42×4g,1mol晶胞的体积为NA·(a×10-10)3cm3,所以晶体密度为ρ=
=4个,不妨取1mol这样的晶胞,则有NA个这样的晶胞,1mol晶胞的质量为42×4g,1mol晶胞的体积为NA·(a×10-10)3cm3,所以晶体密度为ρ=![]() =
=![]() g·cm-3。故答案为:
g·cm-3。故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
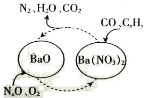
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
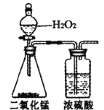
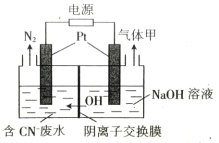
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
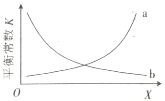
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 原子最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)E元素在周期表中的位置是_________________________。
(2)写出D元素基态原子的简化电子排布式:__________。
(3)这5种元素中电负性最大的元素是__________(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________________(填元素符号)。
(4)B、C、D的简单离子的半径由大到小的顺序为____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式:_____________________。