题目内容
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
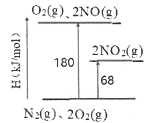
I.(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 moI NO2的能量变化)。1 moI NO氧化为NO2的焓变△H=___________kJ/mol。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g)![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___________(填“a”或“b”);反应2NO(g)+O2(g)![]() 2NO2(g)的K=___________。
2NO2(g)的K=___________。
(3)已知反应2NO(g)+O2(g)![]() 2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
2NO2(g)的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,该反应的历程为:
第一步:NO+NO=N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),ν(逆)=k-1c(N2O2)。下列叙述正确的是___________(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
II.氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯氨、二氯氨和三氯氨(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。工业上可利用反应2C12(g)+NH3(g)![]() NHCl2(l)+HCl(g)制备二氯胺。
NHCl2(l)+HCl(g)制备二氯胺。
(1)二氯氨在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质,写出具有强杀菌作用的物质的电子式______________________。
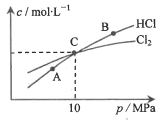
(2)在恒温条件下,将2 mol Cl2和1 moI NH3充入某密闭容器中发生上述反应,测得平衡时Cl2和HC1的物质的量浓度与平衡总压的关系如图所示。则A、B、C三点中Cl2转化率最高的是___________点(填“A”“B”或“C”);计算C点时该反应的压强平衡常数Kp(C)=___________(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数。)
【答案】-56 b 3.3×1013 AC 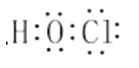 B 0.5 MPa-1
B 0.5 MPa-1
【解析】
I. (1 )由图结合盖斯定律计算出生成1molNO放出的热量;
(2 )平衡常数越大,反应的向正反应方向进行的程度越大;
反应b-a得2NO(g)+O2(g)= 2NO2(g) , K=![]() ;
;
(3)A、根据平衡常数的定义分析;
B、v(第一步的正反应)是快反应;
C、第二步的反应难,活化能高;
D、第二步中N2O2与O2的有效碰撞率小,反应难;
II.(1)二氯胺是重要的水消毒剂,其原因是由于二氯胺在中性、酸性环境中会发生水解生成的次氯酸具有强氧化性;
(2)①反应前后气体体积减小,生成氯化氢越多,氯气转化率越大;
②C点HCl和Cl2浓度相同,结合三行计算列式得到平衡状态下物质的物质的量,分压=总压×物质的量分数,Kp是平衡分压代替平衡浓度计算。
I. (1 )图中表示生成2 mol NO2的能量変化,①N2(g)+ 2O2(g) =2NO2(g) △H=+68kJ/mol;
②N2(g)+O2(g) =2NO(g) △H=+180 kJ/mol;由盖斯定律,①-②得2NO(g) + O2(g)= 2NO2(g) △H=-112 kJ/mol,两边同除以2得: NO(g) +![]() O2(g) = NO2(g) △H= -56 kJ/mol;
O2(g) = NO2(g) △H= -56 kJ/mol;
(2 )平衡常数越大,反应的向正反应方向进行的程度越大,b.2NO(g)![]() N2(g)+O2(g) 平衡常数K=2.2×1030大 ,故选b ;
N2(g)+O2(g) 平衡常数K=2.2×1030大 ,故选b ;
由反应(b-a)可得2NO(g)+O2(g) = 2NO2(g) , 故K=![]() =3.3×1013;
=3.3×1013;
(3)A、第一步反应的平衡常数K=(N2O2)/c2(NO),平衡时v(正)=v(逆)=k1c2(NO)=k-1c(N2O2) ,得c(N2O2)/c2(NO)=k1k-1 , K=c(N2O2)/c2(NO)==k1/k-1 ,选项A正确;
B、v(第一步的正反应)是快反应, v(第二步的反应)是慢反应, v(第一步的正反应)>v(第二步的反应) ,选项B错误;
C、第二步的反应难,活化能高,第二步的活化能比第一 步的活化能高,选项C正确;
D、第二步是慢反应,说明N2O2与O2的有效碰撞的几率较小,不可能达到100%,选项D错误。
答案选AC;
II.(1)二氯胺是重要的水消毒剂,其原因是由于二氯胺在中性、酸性环境中会发生水解生成的次氯酸具有强氧化性,次氯酸的电子式为![]() ;
;
(3)①2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),反应前后气体体积减小,气体压强减小,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,三点中B点HCl最多,则B点氯气转化率最大,
NHCl2(l)+2HCl(g),反应前后气体体积减小,气体压强减小,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,三点中B点HCl最多,则B点氯气转化率最大,
故答案为:B;
②设反应氨气物质的量x,
2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),
NHCl2(l)+2HCl(g),
起始量(mol) 2 1 0 0
变化量(mol) 2x x x 2x
平衡量(mol)2-2x 1-x x 2x
2-2x=2x,得x=0.5mol,
总物质的量=3-3x+2x=3-x=2.5mol,总压强为10MPa
平衡分压代替平衡浓度计算C点时该反应的压强平衡常数Kp(C)=![]() =
=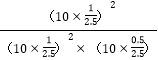 =0.5MPa-1。
=0.5MPa-1。

 学业测评一课一测系列答案
学业测评一课一测系列答案



