题目内容
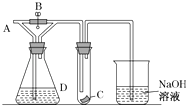
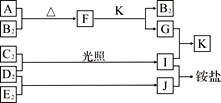
【题目】下图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是
A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
【答案】A
【解析】I与J反应生成铵盐,则它们分别是NH3与HX(X代表卤素,短周期中是F、Cl中的一种,下同),得到这两种氢化物的反应物是N2、H2、X2,共同需要的反应物D2为H2,从反应条件看,H2与X2可以光照生成HX,而N2与H2反应生成NH3需要在催化剂加热加压条件下才能合成,所以C2为X2,E2 为N2,I为HX,J为NH3。G的焰色反应为黄色,说明G是钠的化合物,反应生成气体K,则可能G是钠的碳酸盐(包括酸式盐)反应生成CO2,或G是钠的亚硫酸盐(包括酸式盐)反应生成SO2,则F是钠的另一种化合物且能够与CO2(或SO2)反应生成相应的上述盐类,同理,A或B中含有钠元素,由于B2是气体,则A中含有钠元素。结合已学反应原理,A是Na单质,B2是O2,二者加热生成Na2O2,K只能是CO2,G是Na2CO3,因为Na2O2与SO2反应生成Na2SO4,不能再与HCl反应生成SO2。结合上述分析,A、B的氢化物是H2O,液态时水分子间存在氢键,而同主族其它氢化物之间只存在分子间作用力,所以水的沸点比同主族其它元素氢化物沸点高,A正确。B、A到E五种元素依次为Na、O、F或Cl、H、N,若C为F,半径顺序为Na>N>O>F>H,与B不符,若C为Cl,半径顺序为Na> Cl>N>O>H,也与B不符,B错误。C、F为Na2O2,电子式是![]() ,既含有离子键又含有非极性共价键,C错误。D、G为Na2CO3,阴离子CO32-在水溶液中能够发生水解从而促进水的电离,D错误。正确答案A。
,既含有离子键又含有非极性共价键,C错误。D、G为Na2CO3,阴离子CO32-在水溶液中能够发生水解从而促进水的电离,D错误。正确答案A。

【题目】在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
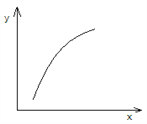
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |