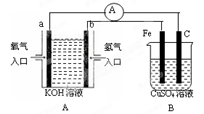
题目内容
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
| A.电路中共转移0.9mol电子 |
| B.阳极得到的气体中有O2且其物质的量为0.35mol |
| C.阴极质量增加3.2g |
| D.铝元素以Al(OH)3的形式存在 |
A
解析试题分析:铝是活泼的金属,因此溶液中铝离子不放电。在电解过程中阴极首先是铜离子放电,然后才是氢离子放电,电极反应式分别为Cu2++2e-=Cu、2H++2e-=H2↑;阳极首先是氯离子放电,然后是溶液中的OH-放电,电极反应式分别为2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O。由于AlCl3、CuCl2和H2SO4的物质的量均是0.1mol,则电解的第一阶段相当于是电解氯化铜,其中析出铜的物质的量是0.1mol,氯气的物质的量是0.1mol。第二降低相当于是电解氯化氢,此阶段产生氢气是0.1mol、氯气是0.1mol。第三阶段相当于是电解氯化铝和水,此阶段产生氯气是0.05mol氯气、氢气是0.05mol。一段时间后在两极收集到的气体在相同条件下体积相同,这说明电解进入第四阶段,此时相当于是电解水,且产生的氢气是氧气的2倍。要使两极收集到的气体在相同条件下体积相同,如果设生成的氧气物质的量是x,则产生的氢气是2x,因此由关系0.25mol+x=0.15mol+2x,解得x=0.1mol,因此最终得到的氯气是0.25mol、氧气是0.1mol,氢气是35mol。A、电路中共转移0.25mol×2+0.1mol×4=0.9mol电子,A正确;B、阳极得到的气体中有O2且其物质的量为0.1mol,B不正确;C、阴极质量增加0.1mol×64g/mol=6.4g,C不正确;D、溶液的铝元素除了以氢氧化铝存在外,还过量的铝离子在溶液中,D不正确,答案选A。
考点:考查电解的有关判断和计算

 全能测控期末小状元系列答案
全能测控期末小状元系列答案如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间。假设在电解过程中产生的气体全部逸出,下列说法正确的是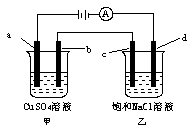
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a电极反应式为:4OH――4e-=O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) |
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是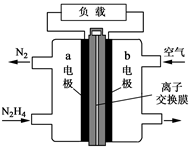
| A.发生氧化反应 |
| B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O |
| C.放电时,电流从a极经过负载流向b极 |
| D.其中的离子交换膜需选用阳离子交换膜 |
为使反应:Cu+2H2O=Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
| A.用铜片作阴、阳电极,电解稀硫酸 |
| B.用铜片作阴、阳电极,电解硫酸铜溶液 |
| C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D.用铜片、石墨、氯化钠溶液、导线等组成原电池 |
已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是
| A.充电时作阳极,放电时作负极 |
| B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 |
| D.充电时作阴极,放电时作正极 |
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH > a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
燃料电池能量利用率可高达80%,下列说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物水经过处理之后可供宇航员使用 |
| C.H2SO4作电解质,氢氧燃料电池的负极反应式H2+2OH--2e-=2H2O |
| D.乙醇燃料电池电解质为KOH,负极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2→2CO2 +3H2O,电池示意如图,下列说法正确的是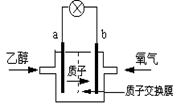
| A.a极为电池的正极 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e→ 2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |