题目内容
美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2→2CO2 +3H2O,电池示意如图,下列说法正确的是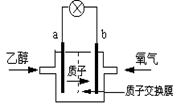
| A.a极为电池的正极 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e→ 2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
C
解析试题分析:A.燃料电池中通入乙醇的电极为负极,通入氧气的电极为正极.即a是负极,b是正极。错误。B. 电池工作时电子由负极a极沿导线经灯泡再到正极b极上。错误。C.电池正极的电极反应为:4H+ + O2 + 4e→ 2H2O。正确。D.由电池反应的总方程式可知:电池工作时,1mol乙醇被氧化时就有12mol电子转移.错误。
考点:考查乙醇电池的化学反应原理及电子转移等知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于下列装置说法正确的是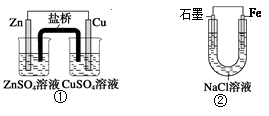
| A.装置①中,盐桥中的K+移向CuSO4溶液 |
| B.装置①中,Zn为负极,发生还原反应 |
| C.装置②中的Fe发生析氢腐蚀 |
| D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
| A.电路中共转移0.9mol电子 |
| B.阳极得到的气体中有O2且其物质的量为0.35mol |
| C.阴极质量增加3.2g |
| D.铝元素以Al(OH)3的形式存在 |
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是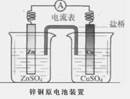
| A.Cu片上发生氧化反应 |
| B.电子由Cu片经外电路流向Zn片 |
| C.盐桥中的Cl―移向ZnSO4溶液 |
| D.一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示(上端为多孔电极a,下断为多孔电极b),该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是
| A.工作时电极b作正极,O2-由电极b流向电极a |
| B.工作时电子由电极a通过介质流向电极b |
| C.负极的电极反应式为:CO+O2—―2e-=CO2 |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
如图用石墨电极电解CuCl2溶液。下列分析正确的是( )
| A.a极发生还原反应 |
| B.每生成6.4 g Cu,转移电子0.2 mol |
C.阳极反应式: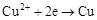 |
| D.在直流电源中电流从b流向a |
Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ( )
| A.锂电极发生氧化反应 |
| B.电子从锂电极通过外电路流向碳电极 |
| C.每生成1mol SO2转移4mol电子 |
| D.SOCl2既是氧化剂又是还原剂 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |