题目内容
有下图所示装置: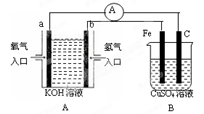
(1)装置A中b为 极,电极反应式为 ,a极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为12.8g时,a极上消耗O2在标准状况下的体积为 L。
(4)若将装置B中的CuSO4溶液更换为100mL滴有酚酞的饱和NaCl溶液,电解一段时间后 极附近颜色变红,当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。
(1)负 2H2-4e-+4OH-=4H2O。O2+4e-+2H2O =4OH-。 (2) 阳 4OH--4e- = O2↑+2H2O
(3) 2.24L。 (4) 阴 14 ( 5) 阳 Cu2++2e-=Cu。
解析试题分析:装置A为原电池,其中b是负极,电极反应式是2H2-4e-+4OH-=4H2O;电极a是正极,电极反应式是O2+4e-+2H2O =4OH-。装置B为电解池,其中C为阳极,电极反应式为4OH--4e- = O2↑+2H2O。n(Cu)=12.8g÷64g/mol=0.2mol.n(e-)=0.4mol.n(O2)=0.1mol.所以V(O2)=2.24L.(4)电解100mL滴有酚酞的饱和NaCl溶液,的方程式为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑.由于电解时H+在阴极放电产生氢气逸出,破坏了附近的水的电离平衡促使水继续电离,最后达到电离平衡,结果C(OH-)>C(H+),溶液呈碱性。故一段时间后在阴极附近溶液的颜色变为红色。若n(H2)= 0.05mol,n(OH-)="0.1mol." C(OH-)=" 0.1mol" ÷0.1L=1mol/L所以C(H+)="Kw/" C(OH-)=10-14mol/L,所以PH="14." (5)若将装置B改为电解精炼铜,则粗铜作阳极,另一极反应为Cu2++2e-=Cu。
2NaOH+Cl2↑+H2↑.由于电解时H+在阴极放电产生氢气逸出,破坏了附近的水的电离平衡促使水继续电离,最后达到电离平衡,结果C(OH-)>C(H+),溶液呈碱性。故一段时间后在阴极附近溶液的颜色变为红色。若n(H2)= 0.05mol,n(OH-)="0.1mol." C(OH-)=" 0.1mol" ÷0.1L=1mol/L所以C(H+)="Kw/" C(OH-)=10-14mol/L,所以PH="14." (5)若将装置B改为电解精炼铜,则粗铜作阳极,另一极反应为Cu2++2e-=Cu。
考点:考查原电池电解池的原理及应用的知识。

把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
| A.电路中共转移0.9mol电子 |
| B.阳极得到的气体中有O2且其物质的量为0.35mol |
| C.阴极质量增加3.2g |
| D.铝元素以Al(OH)3的形式存在 |
如图用石墨电极电解CuCl2溶液。下列分析正确的是( )
| A.a极发生还原反应 |
| B.每生成6.4 g Cu,转移电子0.2 mol |
C.阳极反应式: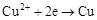 |
| D.在直流电源中电流从b流向a |
Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ( )
| A.锂电极发生氧化反应 |
| B.电子从锂电极通过外电路流向碳电极 |
| C.每生成1mol SO2转移4mol电子 |
| D.SOCl2既是氧化剂又是还原剂 |
关于下列各装置图的叙述中,不正确的是 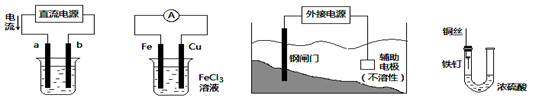
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.为防止钢闸门被腐蚀,装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是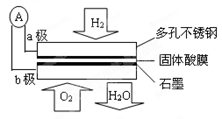
| A.电子通过外电路从b极流向a极 |
| B.每转移0.1mol电子,消耗1.12L的H2 |
| C.b极上的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| D.H+由a极通过固体酸膜电解质传递到b极 |
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是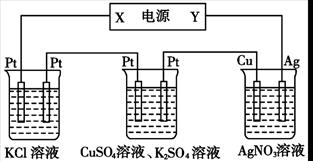
甲 乙 丙
| A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.乙中左侧电极反应式:Cu2++2e-=Cu |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
