题目内容
为使反应:Cu+2H2O=Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
| A.用铜片作阴、阳电极,电解稀硫酸 |
| B.用铜片作阴、阳电极,电解硫酸铜溶液 |
| C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D.用铜片、石墨、氯化钠溶液、导线等组成原电池 |
C
解析试题分析:活动性顺序Cu弱于H,所以Cu不能置换出氢气,而要让已知反应发生,则需要构成一个电解池。该电解池Cu作阳极,失去电子产生Cu2+,阴极材料铜片、铁片均可,阴极发生还原反应,H+得到电子被还原生成H2,要使电解反应与已知方程式相同,则阳极电解铜,阴极电解水,所以满足条件的是C,故选C。
考点:本题考查的是根据已知方程式设计电解池。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
某原电池总反应为:Cu+2Fe3+=Cu2++2Fe2+下列能实现该反应的原电池是
| | A | B | C | D |
| 电极材料 | Cu、Zn | Cu、Ag | Cu、C | Fe、Zn |
| 电解液 | FeCl3 | Fe2(SO4)3 | Fe(NO3)2 | CuSO4 |
关于下列装置说法正确的是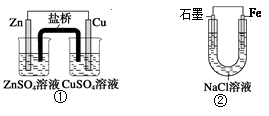
| A.装置①中,盐桥中的K+移向CuSO4溶液 |
| B.装置①中,Zn为负极,发生还原反应 |
| C.装置②中的Fe发生析氢腐蚀 |
| D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是
| A.a为负极,b为正极 | B.a为阳极,b为阴极 |
| C.电解过程中,氯离子浓度不变 | D.电解过程中,d电极质量增加 |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- ="2Ag" +2OH-。下列说法错误的是
| A.溶液中OH-向正极移动 | B.锌发生氧化反应 |
| C.氧化银是正极 | D.在电池放电过程中,电解质溶液的碱性增强 |
下列现象与电化学腐蚀无关的是( )
| A.生铁比纯铁更易生锈 |
| B.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C.银质奖章久置后易表面变暗 |
| D.海轮上一般会在吃水线下绑定一定量的锌块 |
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是
| A.电路中共转移0.9mol电子 |
| B.阳极得到的气体中有O2且其物质的量为0.35mol |
| C.阴极质量增加3.2g |
| D.铝元素以Al(OH)3的形式存在 |
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是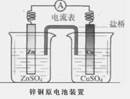
| A.Cu片上发生氧化反应 |
| B.电子由Cu片经外电路流向Zn片 |
| C.盐桥中的Cl―移向ZnSO4溶液 |
| D.一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ( )
| A.锂电极发生氧化反应 |
| B.电子从锂电极通过外电路流向碳电极 |
| C.每生成1mol SO2转移4mol电子 |
| D.SOCl2既是氧化剂又是还原剂 |