题目内容
15.已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能是( )| A. | 431 kJ•mol-1 | B. | 946 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
分析 反应热=反应物的总键能-生成物的总键能,以此解答.
解答 解:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,令N≡N的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反应热=反应物的总键能-生成物的总键能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=946kJ/mol,
故选:B.
点评 本题考查反应热的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,掌握反应热与键能的关系是关键.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 | |
| C. | 总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物是同系物 |
3.四种短周期元素在元素周期表中的位置如图,其中Z的原子半径最小.下列说法正确的是( )
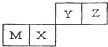

| A. | M元素一定为金属元素 | |
| B. | X元素的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱 | |
| D. | Z元素与氢元素能形成原子个数比为1:1的共价化合物 |
10.下列说法错误的是( )
| A. | 双原子单质分子中的共价键一定是非极性键 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
4.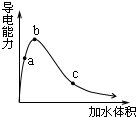 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )| A. | a、b、c三点醋酸的电离程度:c<a<b | |
| B. | a、b、c三点醋酸电离平衡常数:c<a<b | |
| C. | a、b、c三点溶液中的CH+:c<a<b | |
| D. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
5.在2L密闭容器中,在一定条件下发生A+3B?2C,在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则ν(A)为( )
| A. | 0.04mol/(L•s) | B. | 0.08mol/(L•s) | C. | 0.4mol/(L•s) | D. | 0.8mol/(L•s) |