题目内容
【题目】下列物质中最难电离出 H+的是( )
A. CH3CH2OH B. CH3COOH C. H2O D. HCl
【答案】A
【解析】A、B、C、D四个选项对应的物质中,CH3CH2OH 是非电解质,不能电离;CH3COOH、 H2O和HCl都是电解质,可以电离出H+,其中HCl是强电解质,最易电离,CH3COOH和 H2O是弱电解质,相对较难电离。所以本题选A。

【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应” 的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有 熔融物落人沙中”。査阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | — |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:________(填“合理”或“不合理”)。
(2)设汁一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为___________。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。若铁被氧化为Fe3+,在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
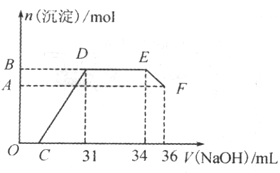
回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____________。在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____________。
(2)B与A的差值为_________mol。B点对应的沉淀的物质的量为___________mol,C点对应的氢氧化钠溶液的体积为____________mL。