题目内容
如图所示,反应:X(气)+3Y(气) 2Z(气)+Q(Q>0),在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为 ( )

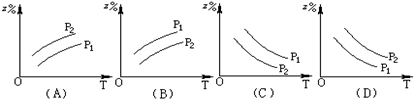


C
由于正反应是气体体积减小的放热反应,所以压强越大、温度越低,Z的百分含量增大,故选C。

练习册系列答案
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
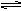 2HI(g);△H<0可逆反应已达化学平衡,下列图象中正确的是( )
2HI(g);△H<0可逆反应已达化学平衡,下列图象中正确的是( )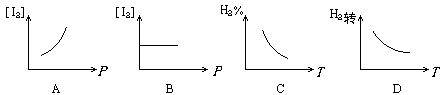
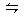 p C(g)+q D(g)的平衡体系,当升高温度时,平衡混合气体对氢气的相对密度从16.5变成16.9,则下列说法正确的是 ( )
p C(g)+q D(g)的平衡体系,当升高温度时,平衡混合气体对氢气的相对密度从16.5变成16.9,则下列说法正确的是 ( ) 2NH3,用υ(H2)和υ(N2)分别表示其中的化合反应的速率,用υ(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
2NH3,用υ(H2)和υ(N2)分别表示其中的化合反应的速率,用υ(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )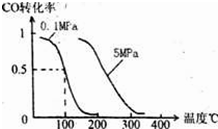

 CO2+H2,达到平衡时,
CO2+H2,达到平衡时,