题目内容
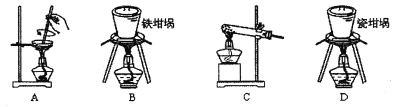
【题目】科学家侯德榜发明的联合制碱法(又称侯氏制碱法)主要原理是:向饱和食盐水中先后通入足量NH3和CO2,生成NaHCO3(在该混合溶液中溶解度较小),加热可得到Na2CO3。某化学小组利用如图装置进行模拟实验,A、B、C、D为备选装置。
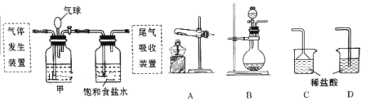
请填写下列空白:
(1)联合制碱法制取NaHCO3的化学方程式为。
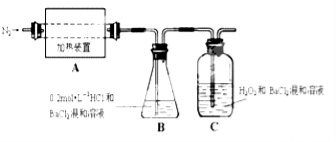
(2)用石灰石和盐酸制取CO2时应选用的气体发生装置为(填字母代号,下同),该反应的离子方程式为;若制NH3选用与实验室制取CO2相同的发生装置,则应选择的试剂为(填试剂的名称)。
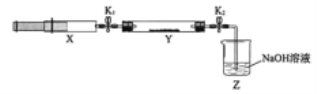
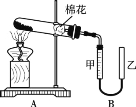
(3)按照如图所示的装置制备NH3,并充入NH3来制备饱和氨盐水,应选用的尾气吸收装置为(填字母代号);甲装置的作用为;该实验过程中应先通入后通入,其原因是。
(4)反应一段时间后,饱和氨盐水中析出NaHCO3晶体,从中得到纯净NaHCO3并进一步制得Na2CO3的操作名称依次是、。
【答案】
(1)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(2)B;CaCO3+2H+=Ca2++2H2O+CO2↑;浓氨水、氢氧化钠固体
(3)C;除去CO2中的HCl,缓冲装置内气体压强变化;NH3;CO2;NH3极易溶于水,而CO2的溶解度较小,这样的顺序便于充分吸收气体,得到更多产品
(4)过滤、洗涤、灼烧
【解析】
试题分析:(1)联合制碱法是在氨化饱和的NaCl溶液里通过量CO2,获得NaHCO3,发生反应的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(2)石灰石和盐酸制取CO2时属固液反应不需要加热,可选用B装置来进行反应,发生反应的离子方程式为CaCO3+2H+=Ca2++2H2O+CO2↑;如制NH3也选用B装置,也需固液反应不加热,可选择的试剂浓氨水与氢氧化钠固体或氧化钙固体反应。
(3)NH3极易溶解于水,尾气处理时应有防倒吸措施,可选用C装置吸收尾气;甲装置的作用为除去CO2中的HCl,同时缓冲装置内气体压强变化;该实验过程中应先通入NH3后通入CO2,其原因是NH3极易溶于水,而CO2的溶解度较小,这样的顺序便于充分吸收气体,得到更多产品。
(4)获得NaHCO3晶体的方法是过滤并洗涤,再将NaHCO3灼烧即可得到Na2CO3。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案