题目内容
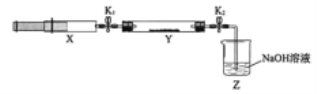
【题目】(1)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
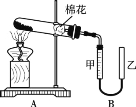
(2) 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示。
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 。
②据报道高锰酸钾受热分解不产生MnO2,已知产气率=![]() ×100%。若只发生KMnO4
×100%。若只发生KMnO4![]() KMnO2+O2↑,则产气率为 。
KMnO2+O2↑,则产气率为 。
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8,写出分解产生这两种物质及氧气的化学方程式: 。
【答案】(1)①红棕色气体慢慢变浅;
②8NH3+6NO2![]() 7N2+12H2O(2分);
7N2+12H2O(2分);
③Z中NaOH溶液产生倒吸现象(2分);
④反应后气体分子数减少,Y管中压强小于外压(2分)。
(2)①使得装置内外压强相等
②20.25%(2分)
③6KMnO4![]() 2K2MnO4+K2Mn4O8+4O2↑(2分)
2K2MnO4+K2Mn4O8+4O2↑(2分)
【解析】
试题分析:(1)打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应 生成无色氮气,所以看到现象为:红棕色气体慢慢变浅;根据反应8NH3+6NO2![]() 7N2+12H2O以及装置恢复至室温后气态水凝聚可判断反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸;
7N2+12H2O以及装置恢复至室温后气态水凝聚可判断反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸;
(2)①移动乙管与甲管中液面相齐,使得装置内外压强相等,再读取装置B中收集到的气体体积;
②在反应KMnO4![]() KMnO2+O2↑中,若参加反应的的物质的量为1mol,则生成氧气的物质的量为1mol,产气率=
KMnO2+O2↑中,若参加反应的的物质的量为1mol,则生成氧气的物质的量为1mol,产气率=![]() ×100%=32g÷158g×100%=20.25%;
×100%=32g÷158g×100%=20.25%;
③KMnO4还会分解产生K2MnO4和K2Mn4O8,根据电子守恒和原子守恒规律,分解产生这两种物质及氧气的化学方程式为6KMnO4![]() 2K2MnO4+K2Mn4O8+4O2↑。
2K2MnO4+K2Mn4O8+4O2↑。

【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素,其配方如下:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3— | H2PO42— | SO42— | Zn2+ |
培养液浓度(g/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是
A. Ca2+ B. SO42— C. Zn2+ D. H2PO42—