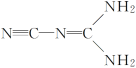
题目内容
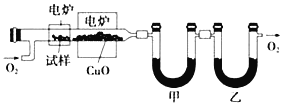
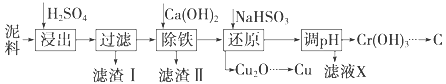
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下图:
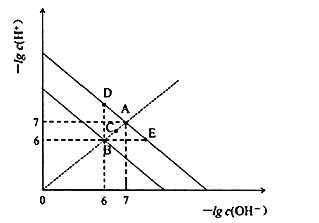
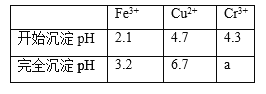
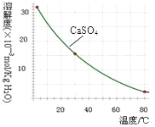
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到__;②将浊液加热到80℃,______.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式___________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是________.
(4)当离子浓度≤1×10﹣5 molL﹣1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH﹣)≥_______.已知:Ksp[Cr(OH)3]=6.3×10﹣31,![]() ≈4.0)
≈4.0)
【答案】CuSO4 3.2 趁热过滤 2H2O+HSO3﹣+2Cu2+=Cu2O↓+SO42﹣+5H+ 产生SO2污染环境 4.0×10﹣9 molL﹣1
【解析】
(1)根据氧化铜和硫酸反应生成硫酸铜和水进行分析;
(2)由图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀pH为4.3,因此在除铁的操作中需要除去Fe3+和CaSO4,而CaSO4溶解度随温度的升高而减小,易于除去;
(3)HSO3-具有较强的还原性,能和Cu2+之间发生反应生成SO42-和Cu2O,过量的HSO3-和酸反应生成SO2和水,;
(4)根据Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)进行计算。
(1)氧化铜和硫酸反应生成硫酸铜和水,所以浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4;
(2)由图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀pH为4.3,因此在除铁的操作中需要除去Fe3+和CaSO4,操作过程为:①加入石灰乳调节pH=3.2;②将浊液加热到80℃,趁热过滤;
(3)HSO3-具有较强的还原性,能和Cu2+之间发生反应生成SO42-和Cu2O,反应为:2H2O+HSO3-+2Cu2+= Cu2O↓+SO42-+5H+,在酸性环境下,HSO3-和H+反应成成的SO2有毒,能污染环境;
(4)当离子浓度≤1×10﹣5 molL﹣1认为沉淀完全,若要使Cr3+完全沉淀,需要让c(OH-)≥ =
=![]() =4.0×10-9mol/L。
=4.0×10-9mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案