题目内容
6.已知硫酸在水中的电离方程式是:H2SO4═H++HSO4-HSO4-?H++SO42-,回答下列问题:(1)Na2SO4溶液显碱性 (填“酸性”,“中性”或“碱性”).理由是(用离子方程式表示)SO42-+H2O?OH-+HSO4-.
(2)在0.1mol•L-1的Na2SO4溶液中,下列微粒浓度关系正确的有BCD.
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1mol•L-1
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(3)如果25℃时,0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则0.1mol•L-1H2SO4溶液中c(SO42-)<0.029mol•L-1(填“<”,“>”或“=”).
(4)0.1mol•L-1NaHSO4溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-).
(5)如果25℃时,0.10mol•L-1H2SO4溶液的pH=-lg 0.11,则25℃时,0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L.
分析 (1)硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-.Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈碱性;
(2)A.溶液中没有H2SO4分子;
B.根据质子守恒分析;
C.根据溶液中的电荷守恒分析;
D.根据Na原子与S原子之间的关系分析;
(3)依据硫酸在水中的第一步电离是完全的,第二步电离并不完全,结合平衡移动分析判断;
(4)0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则c(HSO4-)>c(SO42-),溶液显酸性;
(5)依据氢离子浓度对硫酸氢根离子的电离平衡影响分析判断.
解答 解:(1)根据硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4-?H++SO42-,则Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性,
故答案为:碱性;SO42-+H2O?OH-+HSO4-;
(2)A.溶液中没有H2SO4分子,c(SO42-)+c(HSO4-)=0.1mol•L-1,故A错误;
B.溶液中存在质子守恒,即c(OH-)=c(H+)+c(HSO4-),故B正确;
C.溶液中存在电荷守恒,即阴离子的负电荷总数等于正电荷总数,则c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),故C正确;
D.c(Na)=2c(S),根据S在溶液中存在形式可知:c(Na+)=2c(SO42-)+2c(HSO4-),故D正确;
故答案为:BCD;
(3)25℃时,0.10mol•L-1的NaHSO4溶液中c( SO42-)=0.029mol•L-1,则0.10mol•L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c( SO42-)<0.029mol•L-1;
故答案为:<;
(4)0.1mol•L-1的NaHSO4溶液中c(SO42-)=0.029mol•L-1,则c(HSO4-)>c(SO42-),溶液显酸性,所以溶液中离子浓度大小关系为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
故答案为:c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-);
(5)若25℃时,0.10mol•L-1H2SO4溶液的pH=-lgO.11,C(H+)=0.11mol/L;依据:①H2SO4=H++HSO4-,②HSO4-?H++S042-.①电离出的氢离子浓度为0.10mol/L;所以②电离出的氢离子浓度为0.11mol/L-0.1.mol/L=0.01mol/L;则0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L;
故答案为:0.01mol/L.
点评 本题考查电解质的电离和离子方程式的书写,溶液中电荷守恒应用,物料守恒的应用,题目难度中等,本题注意把握题意,突破硫酸为二元强酸的思维,从题目实际出发,加强自学能力的培养.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
| A. | 化合反应和分解反应一定是氧化还原反应 | |
| B. | CO2+H2O=H2CO3 是化合反应但不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应,复分解反应不可能属于氧化还原反应 | |
| D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 不是置换反应但是氧化还原反应 |
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 饱和NaCl溶液中通入HCl气体有晶体析出 | |
| C. | 500℃左右比室温更有利于合成氨反应 | |
| D. | 滴有酚酞试液的氨水中加入少量醋酸铵晶体,溶液红色变浅 |
| A. | 丁达尔效应是溶液和胶体的本质区别 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
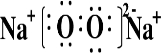 ;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.
;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4. .
.