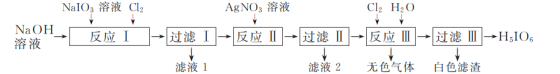
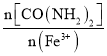题目内容
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)基态K原子中,核外运动状态不同的电子共________种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K________(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为________,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为________
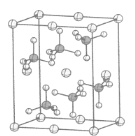
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。
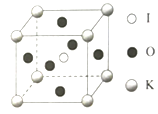
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为________nm,与K紧邻的O的个数为________。
【答案】19 球形 < < 三角锥形 sp3杂化 HIO4中的非羟基氧原子数目更多,使得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强 ![]() nm 或0.386 nm 12
nm 或0.386 nm 12
【解析】
(1)每个电子运动状态都不相同,4S能级的电子云轮廓图形状为球形;
(2)K和Cr属于同一周期,K的原子半径较大,较容易失去电子。K的原子半径较大,且价电子较少,金属键较弱;
(3)若中心原子A有孤电子对,根据中心原子价层电子对判断VSEPR模型,结合孤电子对判断空间构型;
(4)HIO4中I的正电性更高,导致I-O-H中O的电子向I偏移,更容易电离出H+,酸性更强;
(5)K与I间的最短距离为体对角线的一半。O位于面心,K位于顶点,1个顶点为12个面共有。
(1)基态K原子的核外电子排布式为1S22S22P63S23P64S1,总共19个电子,每个电子运动状态都不相同,则核外运动状态不同的电子共19种,占据最高能级为4S,电子云轮廓图形状为球形;
(2)K和Cr属于同一周期,K的原子半径较大,较容易失去电子,故第一电离能:K<Cr。K的原子半径较大,且价电子较少,金属键较弱,金属键强度:K<Cr;
(3)IO3-离子中心原子I原子价层电子对为![]() =4, VSEPR模型为四面体,由于含1对孤电子对,故空间构型是三角锥形,中心原子杂化方式是sp3杂化;
=4, VSEPR模型为四面体,由于含1对孤电子对,故空间构型是三角锥形,中心原子杂化方式是sp3杂化;
(4)HIO4的酸性强于HIO3,是因为HIO4中非羟基氧原子的数目更多,便得I的正电性更高,导致I-O-H中O的电子向I偏移,羟基更容易电离出H+,酸性更强;
(5)K与I间的最短距离为体对角线的一半,则K与O间的最短距离为![]() a=
a=![]() 0.446nm
0.446nm![]() 。O位于面心,K位于顶点,1个面心的原子参与形成2个晶胞,1个顶点参与形成8个晶胞,每个晶胞中与K紧邻的O个数为3个,故在晶体中,与K紧邻的O数目是12个。
。O位于面心,K位于顶点,1个面心的原子参与形成2个晶胞,1个顶点参与形成8个晶胞,每个晶胞中与K紧邻的O个数为3个,故在晶体中,与K紧邻的O数目是12个。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】某实验小组对H2O2分解反应进行实验探究:将质量相等状态不同的MnO2分别加入盛有等体积等浓度的H2O2溶液的大试管中,并用带火星的木条在试管口测试。有关记录如下:
MnO2 | 触摸试管 | 现象 | 反应时间/min |
粉末 | 发烫 | 反应剧烈,带火星的木条迅速复燃 | t1 |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | t2 |
(1)试管中化学反应方程式:____________。
(2)实验结果证明了催化剂的催化效果与____________有关。
(3)表中t1____________t2(填写“>”、“<”或“=”)
(4)控制该反应速率,除了改变催化剂因素,可行的方法还有____________。
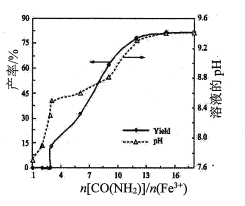
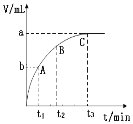
(5)某同学用一定浓度的H2O2溶液10mL,加入适量MnO2在某温度下反应,测量放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是____________点。
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是________。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用________(填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是________。
(3)实现步骤④必须用到的两种仪器是________(供选仪器:a. 烧杯;b. 坩埚;c. 蒸馏烧瓶;d. 高温炉;e. 表面皿;f. 锥形瓶)。
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
(NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,______,冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_____至铁屑完全溶解,_____,冷却结晶,用无水乙醇洗涤2~3次,低温干燥。[实验中必须使用的试剂:铁屑、1.0 mol·L-1的Na2CO3溶液、3.0 mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液]